
题目列表(包括答案和解析)
(12分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。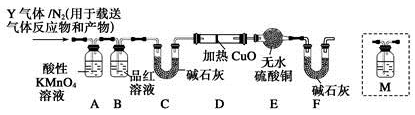
(3)装置B中试剂的作用是 。
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于 (填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
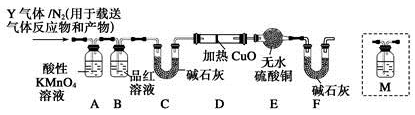
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据根据回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式 ;

(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ;现有含FeS260%的黄铁矿100t,如果在煅烧的过程中,S损失了18%,则可生产质量分数为98%的硫酸 吨。
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是 ;
(4)工业上利用2SO2(g)+O2(g)====2SO3(g)反应制备SO3,下表是在一定条件下测定的SO2的转化率,根据表格中提供的数据,请选择工业利用该反应制备SO3的温度与压强 。
|
转化率 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(5)为检验从接触室出来的气体成分,甲同学设计如下实验:

①A中盛放的试剂是 ;
②B中盛放98.3%浓硫酸的作用是 ,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案 (填“可行”或“不可行”说明理由 ;
③C中盛放的试剂是 ,其作用是 ;
(6)在硫酸工业的尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可采用过量氨不吸收,反应的离子方程式是 。
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| ||
| ||
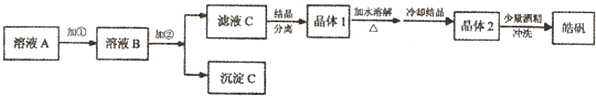
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号 | ① | ② | ③ | ④ |
稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
NO体积(L) | 1.12 | 2.24 | 3.36 | V |
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com