
题目列表(包括答案和解析)
下列各组金属混合物质量相同,它们分别跟足量盐酸反应,在相同状况下产生氢气的体积也相同,则其中锌的质量分数最高的是
[ ]
A.Zn和Al B.Zn和Fe C.Zn和Mg D.Zn和Na
下列各组金属混合物的质量相同,它们分别跟足量盐酸反应,在相同状况下产生氢气的体积也相同,其中锌的含量最多的是
[ ]
|
下列各组金属混和物的质量相同,它们分别跟足量盐酸反应,在相同的条件下产生的氢气体积也相同,则其中锌的含量最多的是 | |
| [ ] | |
A. |
锌和铁 |
B. |
锌和铝 |
C. |
锌和镁 |
D. |
锌和钠 |
某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:
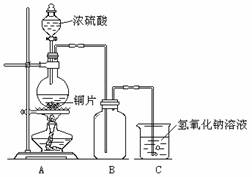
请回答下列问题:
(1)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是_______(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
②实验中若有m g铜参加了反应,则有______mol硫酸被还原。
(2)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案1:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案2:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案3:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。
实际上,以上方案1、2均不可取,请你说出原因?
方案1: 。方案2: 。
方案3:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL) ___________________ _。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com