
题目列表(包括答案和解析)
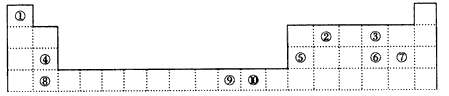
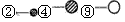 顺序,用元素符号表示)。
顺序,用元素符号表示)。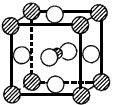
(12分)(1)H+可与H2O形成H3O+,H3O+中O原子采用  杂化,其键角比水分子 (填“大”或“小”)。
杂化,其键角比水分子 (填“大”或“小”)。
(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中晶体类型相同的是 ;(填写编号)。
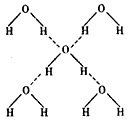
(3)在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmol 氢键所需的能量即为 氢键的“键能”)是 kJ / mol 。
氢键的“键能”)是 kJ / mol 。
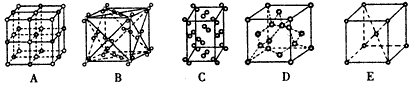
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3,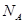 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
(5)在酸性溶液中,发生的氧化还原反应中被氧化与被还原的的元素的物质的量之比为2:5,
□KBiO3+□MnSO4+□H2SO4==□Bi2(SO4)3+□ +□ +□
写出Bi同主族第四周期元素的电子排布式:
 杂化,其键角比水分子 (填“大”或“小”)。
杂化,其键角比水分子 (填“大”或“小”)。
 氢键的“键能”)是 kJ / mol 。
氢键的“键能”)是 kJ / mol 。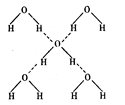
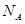 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。[化学—选修物质结构和性质](15分)
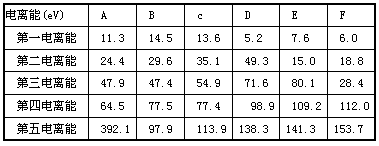
下表为部分短周期元素的性质或原子结构,已知A—D的原子序数依次增大。
|
元素编号 |
元素性质或原子结构 |
|
A |
A原子所处的周期数、族序数、原子序数均相等 |
|
B |
核外电子有6种不同运动状态 |
|
C |
最简单氢化物的水溶液呈碱性 |
|
D |
基态原子的S轨道电子数等于P轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号)
A:(1)写出C原子的电子排布图____________
(2)A、B、C、D的第一电离能由大到小的顺序为______________
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因 _______________
B:按照共价键理论,分子中每个原子的最外电子层电子数均已饱和。已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是___________。向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为______________分子中C的原子的杂化类型是______________;若无配位键则ABCD的结构式为___________分子中D原子的杂化类型为______________。
(5)BD2的电子式是____________将D原子换成等电子的 所得ABCD的结构式为________,分子中C原子的杂化类型是______________。
所得ABCD的结构式为________,分子中C原子的杂化类型是______________。
(6)在ABCD的三种可能结构中B原子的杂化类型__________(填“相同”或“不相同”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com