
题目列表(包括答案和解析)
(12分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
则,A的化合价 ▲ B的化合价(填“>”、“<”或“=”)。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),
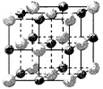
其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: ▲ ,原因是: ▲ 。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)某配合物的分子结构如右图所示,

则N原子的杂化方式为 ▲ ;基态Ni原子的电子排布式 ▲ 。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A的化合价 B的化合价(填“>”、“<”或“=”)。

(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如上图所示),其中3种离子晶体的晶格能数据如下表:
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。

(4)某配合物的分子结构如上图所示,则N原子的杂化方式为 ;基态Ni原子的电子排布式 。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |

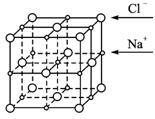
NaCl晶体结构示意图
图1-1-1
(1)将固体NaCl细粒干燥后,准确称取m g NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积V cm3。
请回答下列问题:
①步骤(1)中A仪器最好使用__________ (填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管__________,理由是____________________。
③能否用水代替苯__________,理由是___________________________________________。
④已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如图1-1-1),用上述测定方法测得的阿伏加德罗常数NA的表达式为_________________________________________。
(3)另一种方法是电解法,方法是:用铂电极电解CuCl2溶液时,当电流为I,通电时间为t(单位:分钟)时,阴极增加的质量为m,在阳极收集到气体体积(标准状况)为V。又知1个电子的电荷量为Q,铜的摩尔质量为M,则计算阿伏加德罗常数NA的算式为( )
A.It/QV B.32It/mQ C.672It/QV D.30MIt/mQ
(4)由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子的化合价a的乘积,其比例系数F是一恒量,称为法拉第常数。它与金属的种类无关。
用电镀法在半径为R的铜球表面均匀镀上很薄的银层,在电解槽中铜球作__________极,另一电极材料是__________。若电流为I,通电时间为t,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度d(用本题中的符号表示)。
(12分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),其中3种离子晶体的晶格能数据如下表:
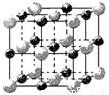
|
离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如右图所示,其分子内不含有 (填序号)。
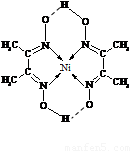
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com