
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||
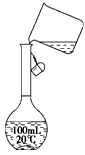
实验室用密度为1.18 g·mL-1,质量分数为36.5%浓盐酸配制250 mL 0.1 mol·L-1的盐酸溶液,填空并请完成下列问题:
(1)配制250 mL 0.1 mol·L-1的盐酸溶液
(2)容量瓶上除有刻度线外还应标有________,在使用前必须检查容量瓶是否完好以及________(填容量瓶的受检部位)处是否漏水.
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)________.
A.用30 mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2-3 cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是________.溶液注入容量瓶前需恢复到室温,这是因为________.
(5)若出现如下情况,对所配溶液浓度将有何影响?(填:偏低;偏高;无影响)
没有进行A操作________;加蒸馏水时不慎超过了刻度________;定容时俯视________.
(6)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面________.
实验室用浓盐酸配制250 mL 0.1 mol·L-1的盐酸溶液.
(1)需要浓盐酸(密度为1.18 g·mL-1、质量分数为36.5%)的体积为________.
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________.
A.用30 mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是________.
(1)配制250 mL 0.1 mol·L-1的盐酸溶液。?
应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其他仪器 |
|
|
|
(2)容量瓶上除有刻度线外还应标有______________,在使用前必须检查容量瓶是否完好以及__________处是否漏水(填容量瓶的受检部位)。?
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)_________。?
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡?
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀?
C.将已冷却的盐酸沿玻璃棒注入250 mL的容量瓶中?
D.将容量瓶盖紧,振荡,摇匀?
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切?
F.继续往容量瓶内小心加水,直到液面接近刻度2~3 cm处?
(4)操作A中,将洗涤液都移入容量瓶,其目的是__________________________。溶液注入容量瓶前需恢复到室温,这是因为______________________。?
(5)若出现如下情况,对所配溶液?浓度?将有何影响?(填:“偏低”“偏高”“无影响”)
没有进行A操作__________________;加蒸馏水时不慎超过了刻度____________________;定容时俯视__________________。?
(6)若实验过程中出现如下情况如何处理??
加蒸馏水时不慎超过了刻度______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面____________________。?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com