A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是
S2->O2->Na+
S2->O2->Na+
(填具体离子符号);由A、B、C三种元素按 4:2:3组成的化合物所含的化学键类型属于
离子键、共价键
离子键、共价键
.
(2)用某种废弃的金属易拉罐与 A、C、D组成的化合物溶液反应,该反应的离子方程式为:
2Al+2OH-+2H2O=2AlOH2-+3H2↑
2Al+2OH-+2H2O=2AlOH2-+3H2↑
.
(3)A、C两元素的单质与熔融K
2CO
3,组成的燃料电池,其负极反应式为
H2+CO32--2e-=CO2↑+H2O
H2+CO32--2e-=CO2↑+H2O
.用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LA
2时,NaCl溶液的PH=
13
13
(假设电解过程中溶液的体积不变)
(4)可逆反应2EC
2(气)+C
2(气)?2EC
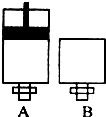
3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B 容器可保持恒容 (如图所示),若在 A、B 中分别充入lmolC
2 和2molEC
2,使V(A )=V( B ),在相同温度下反应,则:①达平衡所需时间:t(A )
<
<
t( B )(填>、<、二,或:无法确定,下同).平衡时 EC
2 的转化率:a( A )
>
>
a( B ).
(5)欲比较C和E两元素的非金属性相对强弱,可采取的措施有
cd
cd
(填“序号”).
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易.





 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
