某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO
2、NH
4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验.
I.(1)从废干电池中提取NH
4Cl.
①利用该糊状物提取NH
4Cl前两步的操作为:a.溶解 b.
.
②甲同学设想:将分离出的NH
4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH
4Cl.
请对甲同学的方案作出评价并说明理由:
.
(2)制取氨气.
①乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
②乙同学认为将集气瓶正放在桌上(如图1所示),就可以收集到纯净的氨气.
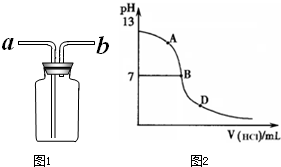
你若认为可行,请说明其操作:
.
你若认为不可行,请说明其理由:
.
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH
3?H
2O是否是弱电解质.
丙该同学设计方案如下:①将1.12L(标况)NH
3完全溶于水,配得溶液500mL;②
;③分析数据,即可得出结论.
请把最简单的实验步骤②,填写在上面的空格中.
(4)探究氨水与盐酸的反应过程.
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图2).请回答:
①酸碱恰好完全中和时的pH点应是
(填A或B或D),②此时溶液中c(NH
3?H
2O)+c(NH
4+)=
mol?L
-1,③溶液中各离子的浓度由大到小的顺序为
.

 向25mL 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是( )
向25mL 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是( )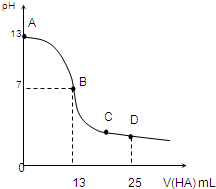 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: