
题目列表(包括答案和解析)
用KMnO4与足量浓度为12mol/L的浓盐酸反应,反应方程式如下:
2KMnO4+16HCl=2KCl+2MnCl 2+ 5Cl 2↑ +8H2O
回答下列问题:
(1)2molKMnO4的质量为多少?
(2)2molKMnO4能氧化的HCl物质的量为多少?
(3)产生的Cl 2在标准状况下的体积为多少?
| |||||||||||
| |||||||||||
(08上海12校第二次联考)在化工生产中,硝酸的制备通常采用催化氧化法,原料主要是氨气和氧气。
问题1:由于二氧化碳不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失)。
(1)从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为 。
(2)如果按理论上的原料将原料放在一个具有反应条件下的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为 。
(3)循环操作的次数与二氧化氮在生成硝酸的转化率具有一定的数学关系。计算一定量的二氧化氮气体大约要经过 次循环操作,才能使二氧化氮的转化率约为96%。
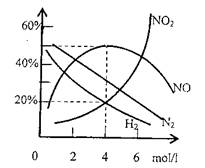
问题2:将上述方法制得的硝酸,可以稀释成浓缩得各种不同浓度的硝酸。大量实验证明,同一金属与不同浓度的硝酸反应可生成不同的还原产物。某研究小组实验研究了镁与不同浓度硝酸反应,测得气体产物主要有H2、N2、NO、NO2,溶液中的产物主要有Mg(NO3)2、NH4NO3、H2O。
(4)现有0.96Mg与足量浓度为4mol/l的HNO3完全
反应,收集到224ml(S.T.P)气体,各气体产物

成分和所有硝酸浓度曲线如右图所示。通过计
算确定还原产物的组成及各成分的物质的量之
比是多少?
(08上海12校第二次联考)在化工生产中,硝酸的制备通常采用催化氧化法,原料主要是氨气和氧气。
问题1:由于二氧化碳不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失)。
(1)从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为 。
(2)如果按理论上的原料将原料放在一个具有反应条件下的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为 。
(3)循环操作的次数与二氧化氮在生成硝酸的转化率具有一定的数学关系。计算一定量的二氧化氮气体大约要经过 次循环操作,才能使二氧化氮的转化率约为96%。
问题2:将上述方法制得的硝酸,可以稀释成浓缩得各种不同浓度的硝酸。大量实验证明,同一金属与不同浓度的硝酸反应可生成不同的还原产物。某研究小组实验研究了镁与不同浓度硝酸反应,测得气体产物主要有H2、N2、NO、NO2,溶液中的产物主要有Mg(NO3)2、NH4NO3、H2O。
(4)现有0.96Mg与足量浓度为4mol/l的HNO3完全
反应,收集到224ml(S.T.P)气体,各气体产物
成分和所有硝酸浓度曲线如右图所示。通过计
算确定还原产物的组成及各成分的物质的量之
比是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com