
题目列表(包括答案和解析)
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)![]() 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
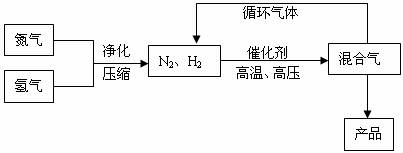
回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g); △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ; △H=-483.6kJ/mol
则工业合成氨的热化学方程式为_______________。
(2)如果工业上,在一定温度下,将1.5molN2 气体和6molH2 气体通入到体积为1升的密闭容器中。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是______。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法?______ (填编号)。①过滤 ②蒸馏 ③渗析 ④萃取 理由是________________________。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为:_________________________________。
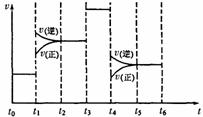
(5)如果化学反应3A2(g)+C2(g)![]() 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T℃时,将4amolA2和2a molC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数____________。
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________。温度为T℃时,将4amolA2和2a molC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数____________。
工业上合成氨的化学反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
ΔH=-92.4 KJ·mol-1、ΔS=-198.3 J·mol-1·K-1,且ΔG=ΔH-T ΔS.在容积为10 L的密闭容器中,通入40 mol N2和120 mol H2在一定条件下进行反应,4 S后达到平衡状态,此时N2的浓度为2 mol/L.通过计算回答下列问题:
(1)在温度为298K时,该反应________(填“能”或“不能”)自发进行.反应进行到平衡状态时ΔG=________.
(2)用N2表示的4S内化学反应的平均速率是________.
(3)在该条件下N2的最大转化率是________;此时混合气体中NH3的体积分数是________.
(4)为了提高氨气的产率,可以选择的方法是________(填序号,错选扣分).
①升高温度
②增大压强
③使用催化剂
④及时分离出NH3
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
 H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
| 3 | 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com