Fe(OH)
2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是
白色沉淀先变成灰绿色,最后变成红褐色
白色沉淀先变成灰绿色,最后变成红褐色
,反应的化学方程式是
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.实验室可用下面两种方法制得白色的Fe(OH)
2沉淀:
方法一:用不含Fe
3+的FeSO
4溶液与不含O
2的蒸馏水配制的NaOH溶液反应制备.
(1)若FeSO
4溶液中含有Fe
3+,可加入Fe粉使其还原,反应的离子方程式是
2Fe3++Fe=3Fe 2+
2Fe3++Fe=3Fe 2+
.
(2)除去蒸馏水中溶解的O
2常采用
煮沸
煮沸
的方法.
(3)生成白色Fe(OH)
2沉淀的操作是用长滴管吸取不含O
2的NaOH溶液,插入FeSO
4溶液液面下,再挤出NaOH溶液.这样操作的理由是
避免生成的Fe(OH)2沉淀接触O2
避免生成的Fe(OH)2沉淀接触O2
.
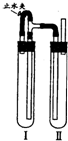
方法二:在如图装置中,试管Ⅰ里加入铁屑、稀H
2SO
4,试管Ⅱ里加入NaOH溶液,为了制得白色Fe(OH)
2沉淀,实验时打开止水夹,塞紧塞子后的实验步骤是
检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹
检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹
.这样生成的Fe(OH)
2沉淀能较长时间保持白色.

 33、用下面两种方法可以制得白色的Fe(OH)2沉淀.
33、用下面两种方法可以制得白色的Fe(OH)2沉淀.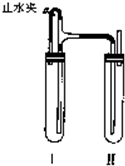 (2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀.
(2011?佛山二模)用下面两种方法可以制得白色的Fe(OH)2沉淀. Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是
Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是