
题目列表(包括答案和解析)
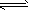 CO2(g)十H2(g) △H<0 此反应的平衡常数表达式K = ____________该温度下,根据下图计算此反应的平衡常数K =___________。升高温度后K值将__________(填“增大、减小或不变”)
CO2(g)十H2(g) △H<0 此反应的平衡常数表达式K = ____________该温度下,根据下图计算此反应的平衡常数K =___________。升高温度后K值将__________(填“增大、减小或不变”) 
A.小于0.45 mol B.等于0.45 mol
C.大于0.45 mol D.在0.45 mol和0.9 mol之间
盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:

(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有 性,实验室不能用浓硫酸干燥氨气,说明硫酸具有 性。
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是 (填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水,则反应的化学方程式为 。
A.有0.9 mol的硫酸被还原 B.有0.45 mol的硫酸被还原
C.充分反应后体系无硫酸剩余 D.消耗的铜的质量少于28.
将0.2 mol/L NaF溶液与0.1mol/L稀硝酸等体积混合后,离子浓度的关系正确的是
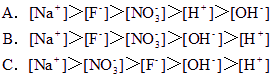
![]()
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com