(2009?广州模拟)某探究小组用KMnO
4酸性溶液与H
2C
2O
4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.
(1)该反应的离子方程式为(提示:H
2C
2O
4的一级电离常数为5.4×10
-2)
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
.
(2)实验条件作如下限定:所用KMnO
4酸性溶液的浓度可选择0.01mol?L
-1、0.001mol?L
-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO
4酸性溶液的用量均为4mL、H
2C
2O
4溶液(0.1mol?L
-1)的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成
4
4
个实验进行对比即可得出结论.
(3)在其它条件相同的情况下,某同学改变KMnO
4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度/mol?L-1 |
溶液褪色所需时间 t/min |
| 第1次 |
第2次 |
第3次 |
| 0.01 |
14 |
13 |
11 |
| 0.001 |
6 |
7 |
7 |
①计算用0.001mol?L
-1 KMnO
4酸性溶液进行实验时KMnO
4的平均反应速率(忽略混合前后溶液的体积变化,写出计算过程).
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?
不可行
不可行
.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:
取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
.

 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是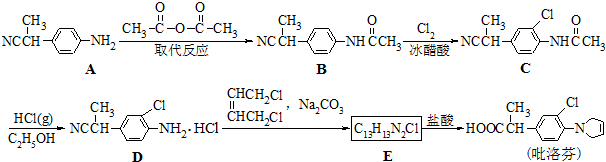
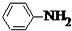 )进行氯化或溴化反应都直接生成2,4,6-三卤苯胺,很难使反应停留在一氯代或一溴代的阶段.
)进行氯化或溴化反应都直接生成2,4,6-三卤苯胺,很难使反应停留在一氯代或一溴代的阶段.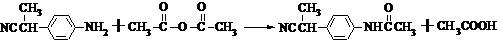
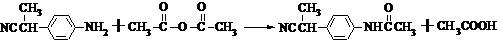
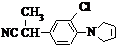
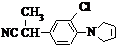
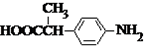 ).写出同时满足下列条件的F的两种同分异构体的结构简式
).写出同时满足下列条件的F的两种同分异构体的结构简式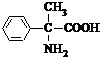 、
、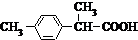
 、
、
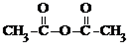 等酸酐反应生成酚酯.请写出由水杨酸(
等酸酐反应生成酚酯.请写出由水杨酸(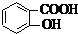 )与
)与 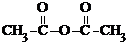 反应的化学方程式
反应的化学方程式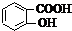 +
+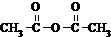 →
→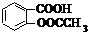 +CH3COOH
+CH3COOH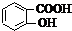 +
+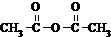 →
→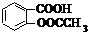 +CH3COOH
+CH3COOH