
题目列表(包括答案和解析)
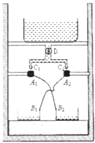 如图所示,铜环A1、A2分别与金属容器B2、B1用导线交叉相连,金属容器放于泡沫塑料上面,两铜环用有机玻璃棒固定,并相对于中轴线对称放置,A1、A2的正上方是两个小滴管的管口,滴管通过阀门D和三通(连通器)与上面的盛水容器相通,打开并调节阀门使C1、C2处形成水滴,并能从两铜环的中心穿过,经过一段时间,会看到水滴在通过铜环时变成了四处飞舞的微小水珠,关于该现象的解释,下列分析中正确的是( )
如图所示,铜环A1、A2分别与金属容器B2、B1用导线交叉相连,金属容器放于泡沫塑料上面,两铜环用有机玻璃棒固定,并相对于中轴线对称放置,A1、A2的正上方是两个小滴管的管口,滴管通过阀门D和三通(连通器)与上面的盛水容器相通,打开并调节阀门使C1、C2处形成水滴,并能从两铜环的中心穿过,经过一段时间,会看到水滴在通过铜环时变成了四处飞舞的微小水珠,关于该现象的解释,下列分析中正确的是( )| A、是风的作用使水滴变成四处飞舞的水珠 | B、水滴下落时与空气的摩擦使水滴散开了 | C、泡沫塑料垫和有机玻璃棒的绝缘性能是保证该实验成功的重要条件 | D、装置所在环境中电荷分布的不均匀,造成铜环的电势不等,对上面C1和C2之间的水产生静电感应,最后使水滴散开的 |
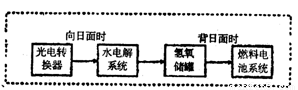
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
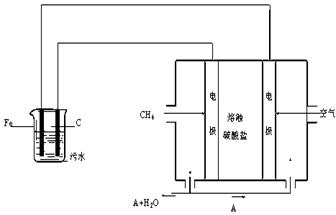
⑴实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
⑵电解池阳极的电极反应分别是① ;
②4OH- - 4 e-= 2H2O + O2↑。
⑶电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
⑷该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
⑸实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)___________L。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
⑴实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
⑵电解池阳极的电极反应分别是① ;
②4OH- - 4 e-= 2H2O + O2↑。
⑶电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
⑷该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 +4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
⑸实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)___________L。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
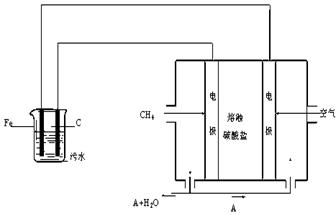
⑴实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
⑵电解池阳极的电极反应分别是① ;
②4OH- - 4 e-= 2H2O + O2↑。
⑶电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
⑷该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是CH4 + 4CO32- - 8e-= 5CO2 + 2H2O。
①正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 。
⑸实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)___________L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com