
题目列表(包括答案和解析)
下列五组物质分离所涉及的实例、性质差异和分离方法的组合正确的是( )
|
有甲、乙、丙三瓶等体积等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水分,在乙中通入少量的CO2,丙不变,然后分别向甲、乙、丙三瓶中加入同浓度的盐酸,完全反应后所需盐酸溶液的体积是( )
A.甲=丙>乙 B.丙>乙>甲 C.乙>甲=丙 D.甲=乙=丙
常温下甲、乙两醋酸溶液,测得甲的pH= a,乙的pH= a+1。下列推断中正确的是
A.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
B.物质的量浓度c(甲)=10c(乙)
C.中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)  3C(g)+D(s),已知将2mol A和1mol
B充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
3C(g)+D(s),已知将2mol A和1mol
B充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中的体积分数为n%。
(1)如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,其结果一定是:C的物质的量为2Wmol,C在平衡混合气体中的体积分数仍为n%的是 。
A.4mol A+2mol B
B.6mol C+1mol D
C.1mol A+0.5mol B+1.5mol C+0.5mol D
D.2mol A+1mol B+3mol C+1mol D
E.2mol A+1mol B+3mol C+2mol D
(2)若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol,则D的起始物质的量n(D)应满足的条件是 (用含W的代数式表示)。
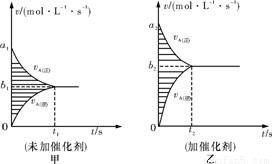
(3)此反应的v-t图象如甲图,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如乙图,请用“=、<、>”填空:
①a1 a2;②b1 b2;③两图中阴影部分面积:甲 乙。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com