
题目列表(包括答案和解析)

已知碳与氧化铜在高温时可同时发生两个反应且均生成红色固体。
|
C + 2CuO === 2Cu + CO2↑;
写出碳与氧化铜在高温时反应生成红色氧化亚铜(化学式为Cu2O)和二氧化碳的化学方程式__________________________________。
(2)现有碳和氧化铜组成的混合物3.12 g,在高温时充分反应。若反应后碳和氧化铜均无剩余且反应产生的气体全部被足量的澄清石灰水吸收,石灰水增重0.44 g。
① 反应前混合物中碳的质量为 g。
② 计算反应后固体混合物中氧化亚铜的质量。
(写出解题过程,计算结果保留两位小数)。
已知碳与氧化铜在高温时可同时发生两个反应且均生成红色固体。
|
C + 2CuO === 2Cu + CO2↑;
写出碳与氧化铜在高温时反应生成红色氧化亚铜(化学式为Cu2O)和二氧化碳的化学方程式:_______。
(2)现有碳和氧化铜组成的混合物3.12 g,在高温时充分反应。若反应后碳和氧化铜均无剩余且反应产生的气体全部被足量的澄清石灰水吸收,石灰水增重0.44 g。
① 反应前混合物中碳的质量为 g。
② 计算反应后固体混合物中氧化亚铜的质量(计算结果保留两位小数)。
2010年1月7日,兰州石化公司石油化工厂的一个装有液化气等轻烃的罐区发生爆炸。消防官兵在灭火中使用了很多水炮对着火的罐体不断喷水,经46小时终于将火扑灭。环保部门监测发现:空气中粉尘颗粒增多,比正常值超出八倍。
(1)水炮灭火的主要原理是 。
(2)目前计人空气污染物的项目为:一氧化碳、二氧化硫、可吸人颗粒物、 等。
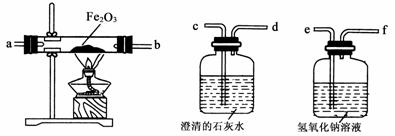
(3)当地某化学兴趣小组想探究爆炸现场附近的空气中是否含有CO气体。设计实验方案如下:
【实验目的】确定气体样品中是否含有CO。
【实验原理】①除去收集的空气样品中的氧气;②3CO+Fe2O3高温2Fe+3CO2(假设该样品中不含除CO之外的其他能与Fe2O3,反应的物质)。
【实验仪器】请根据他们的设计回答下列问题:
①在实验时,上述仪器的连接顺序是:丙→乙→甲→乙。其中乙装置需要使用两次,第一次的作用是 。
②根据实验中出现的
或 现象,能判断出爆炸现场附近的空气样品中有较多CO。
③从环境保护的角度考虑,你认为该实验的设计是否存在缺陷,如果有,该如何改进?
。
南宁至钦州段的高速铁路正在建设中。请回答下列问题:
(1)铁路建设中大量使用了以下材料:①石子;②钢筋水泥柱;③钢轨等,其中钢轨属于 。
A.金属材料 B.合成材料 C.有机天然材料 D.无机非金属材料
(2)建设中,常用铝和氧化铁(Fe2O3)在高温条件下,反应生成熔融状态下的铁单质对钢轨中的缝隙进行焊接。反应的化学方程式为:Fe2O3+2Al X+2Fe,则X的化学式为
,该反应的基本类型是 。
(3)钢轨长时间使用后会生锈。铁锈的主要成分是Fe2O3·xH2O;除铁锈常用的一种试剂是 。
(4)请写![]() 出防止铁制品锈蚀的两种常用方法:① ;② 。
出防止铁制品锈蚀的两种常用方法:① ;② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com