
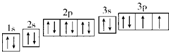
题目列表(包括答案和解析)
| ||
| X | ||||
| R |
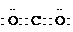
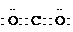
 Al(OH)3+3HCl↑
Al(OH)3+3HCl↑ Al(OH)3+3HCl↑
Al(OH)3+3HCl↑| X | Y | Z | |
| R | |||
| W | |||
| J |

 (2011?崇明县一模)如图,MOH和ROH两种一元碱的稀溶液,分别加水稀释时pH变化可近似看作下图,下列说法错误的是( )
(2011?崇明县一模)如图,MOH和ROH两种一元碱的稀溶液,分别加水稀释时pH变化可近似看作下图,下列说法错误的是( )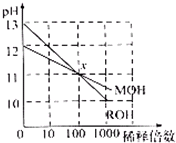 (2014?滨州一模)常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
(2014?滨州一模)常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com