
题目列表(包括答案和解析)
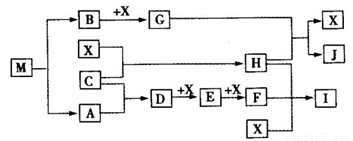
(15分)离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示: ☆
(1)实验室中物质I应如何保存? 。
(2)写出D与X反应的化学方程式 。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式 ; 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者 后者.(填大于、等于或小于)
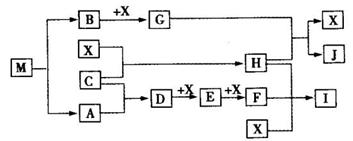
(15分)离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示: ☆
(1)实验室中物质I应如何保存? 。
(2)写出D与X反应的化学方程式 。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式 ; 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者 后者.(填大于、等于或小于)
离子化合物M(化学式为NaN3)在汽车安全气囊中有重要的作用,M与其他物质的转化关系如下图所示。已知:常温下G为淡黄色固体,H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X分别为空气的主要成分之一。I、J为常见的工业原料。相关转化关系如图所示: ☆
(1)实验室中物质I应如何保存? 。
(2)写出D与X反应的化学方程式 。
(3)G,F均能氧化SO2 ,若前一反应仅生成一种盐,后一反应生成两种氧化物,写出相应化学方程式 ; 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出a kJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
(6)相同条件下,等体积等物质的量浓度的M溶液和NaCl溶液中,阴、阳离子总数的关系是前者 后者.(填大于、等于或小于)

| ||
| ||
| ||
| ||
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导热剂乙炔黑和铝箔等,充电时,该锂离子电池负极发生的反应为6C+xLi+xe—==LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
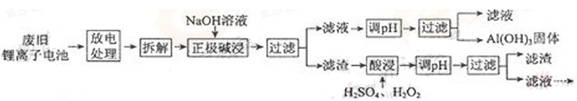

回答下列问题:
(1)LiCoO2中,Co元素的化合价为
(2)写出“正极碱浸”中发生反应的离子方程式
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式
;可用盐酸代替H2SO4和H2O2的混合液,但缺点是
(4)写出“沉钴”过程中发生反应的化学方程式
(5)充放电过程中,发生LiCoO2与Li1—xCoO2之间的转化,写出放电时电池反应方程式
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是
。在整个回收工艺中,可回收到的金属化合物有
(填化学式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com