
题目列表(包括答案和解析)
摩尔质量和气体摩尔体积
1.摩尔质量
单位物质的量的物质所具有的质量叫做摩尔质量(符号M).准确理解摩尔质量的概念,须注意以下几点:
(1)单位:SI中,摩尔质量的单位是kg·mol-1,中学阶段常用________,此外,还有kg·kmol-1,mg·mmol-1等,其中:1 g·mol-1=1 kg·kmol-1=1 mg·mmol-1.
(2)符号:摩尔质量的符号是M,如氧气的摩尔质量可表示为________.
(3)数值:当摩尔质量以g·mol-1为单位时:
M=Mr g·mol-1或M=Ar g·mol-1,
即它们的纯数值是相等的.
(4)由摩尔质量的概念,得到下列公式:n=![]()
2.气体摩尔体积
在一定的温度和压强下,单位物质的量气体所占的体积叫做气体摩尔体积(符号Vm).
标准状况下,气体的摩尔体积(Vm,0)约为22.4 L·mol-1.
注意:(1)气体摩尔体积不是“体积”,单位不是体积单位L、m3等,其常用单位为:L·mol-1,其SI单位为m3·mol-1.
(2)从气体摩尔体积的概念可抽象气体摩尔体积的公式.即Vm=![]() (或n=
(或n=![]() )
)
(3)概念中“单位物质的量”可以是1 mol,也可以是1 mmol或1 kmol等.
3.影响物质体积的因素
(1)物质所含粒子数的多少.物质所含粒子数________,________越大.
(2)物质所含粒子的________.
(3)物质内粒子间的________.
对固体和液体物质来说,(1)(2)起主要作用;对气体物质来说,(1)(3)起主要作用.
4.阿伏加德罗定律
在相同的温度和压强下,________,这个定律叫做阿伏加德罗定律.
准确理解阿伏加德罗定律要注意以下几点:
(1)使用范围:阿伏加德罗定律的使用范围是________物质,可以是单一气体,也可是混合气体.
(2)表述方式:阿伏加德罗定律的特征是“四同”——同温、同压、同体积、同分子数,其中三个量相同,第四个量必然相同.即阿伏加德罗定律可以有四种表述方式:
①当T、p、N(或n)相同时,V必相同.
②当T、p、V相同时,N(或n)必相同.
③当T、V、N(或n)相同时,p必相同.
④当p、N(或n)、V相同时,T必相同.
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
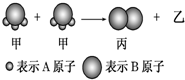 如图:2个甲分子反应生成1个丙分子和3个乙分子,下列说法错误的是( )
如图:2个甲分子反应生成1个丙分子和3个乙分子,下列说法错误的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com