
题目列表(包括答案和解析)
将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是____________;
②原硝酸溶液的物质的量浓度为__________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1582 | 0.00 | 29.90 | 40.90 |
| 0.1582 | 0.00 | 30.10 | 41.10 |
| 0.1582 | 0.00 | 32.10 | 43.10 |
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1582 | 0.00 | 29.90 | 40.90 |
| 0.1582 | 0.00 | 30.10 | 41.10 |
| 0.1582 | 0.00 | 32.10 | 43.10 |
| ||
| ||
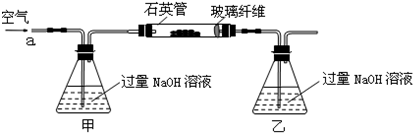
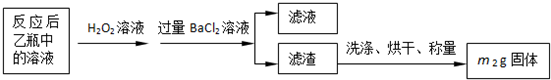
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
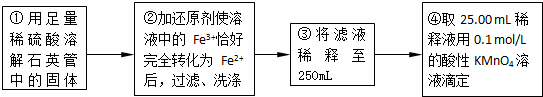
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com