
题目列表(包括答案和解析)
2- 4 |
2- 3 |
2- 3 |
- 3 |
- 3 |
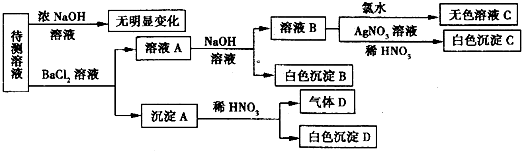
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 | HCO3- HCO3- |
Br- Br- |
BaSO4 BaSO4 |
2- 3 |
2- 4 |
某强酸性溶液X可能含有Ba2+、Al3+、NH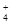 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO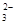 、SO
、SO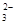 、SO
、SO 、Cl-、NO
、Cl-、NO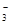 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下: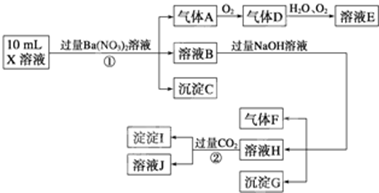
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是______,不能确定是否含有的离子(M)是______,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是______.
(2)写出反应②的离子方程式:______.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式______.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有______.
A、B、C、D、E五种盐,它们的阳离子可能是Na+、NH![]() 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO![]() 、SO
、SO![]() 、CO
、CO![]() .已知:
.已知:
①五种盐均溶于水,水溶液均为无色.
②D的焰色反应呈黄色.
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性.
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀.
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失.
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
回答下列问题:
(1)五种盐中,一定没有的阳离子是________;所含的阴离子相同的两种盐是(用编号表示)________.
(2)D的化学式为________,推断的理由是________.
(3)A和C的溶液反应的离子方程式是:________.
(4)若要检验B中所含的阳离子,正确的实验方法是________.
+ 4 |
- 3 |
2- 3 |
2- 4 |
- 2 |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com