晶体硅是一种重要的非金属材料.制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅 ②粗硅与干燥HCl气体反应制SiHCl
3:Si+3HCl
SiHCl
3+H
2③SiHCl
3与过量H
2在1000~1100℃反应制得纯硅.
已知SiHCl
3能与H
2O强烈反应,在空气中易自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
.
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl
3(沸点33.0℃)中含有少量SiCl
4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl
3采用的方法为:
分馏
分馏
.
(3)用SiHCl
3与过量H
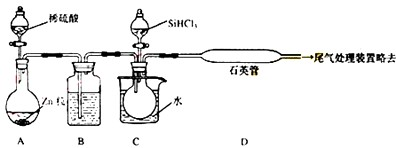
2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是
浓硫酸
浓硫酸
,装置C中的烧瓶需要加热,其目的是:
使滴入烧瓶中的SiHCl3气化
使滴入烧瓶中的SiHCl3气化
.
②反应一段时间后,装置D中观察到的现象是
英管的内壁附有灰黑色晶体
英管的内壁附有灰黑色晶体
,装置D不能采用普通玻璃管的原因是
高温下,普通玻璃会软化
高温下,普通玻璃会软化
,装置D中发生反应的化学方程式为
.
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
先通一段时间H2,将装置中的空气排尽
先通一段时间H2,将装置中的空气排尽
.
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
bd
bd
a.碘水b.氯水c.NaOH溶液d.KSCN溶液e.Na
2SO
3溶液.

 Si+2CO↑
Si+2CO↑  SiCl4
SiCl4  Si(纯)+4HCl
Si(纯)+4HCl ![]() Si +2CO↑
Si +2CO↑ ![]() SiCl4
SiCl4![]() Si + 4HCl
Si + 4HCl