
题目列表(包括答案和解析)
钠加热后能在空气中着火燃烧的现象是
[ ]
A.黄色火焰, 生成白色固体Na2O B.黄色火焰, 生成淡黄色固体Na2O2
C.紫色火焰, 生成淡黄色固体Na2O2 D.红色火焰, 生成黄色固体Na2O
| 结构简式 | HOOH-COOH | |||
| 溶解性 | 能溶于水,易溶于乙醇 | |||
| 特性 | 大约在157℃升华(175℃以上发生分解) | |||
| 化学性质 | H2C2O4+Ca(OH)2═CaC2O4↓+2H2O | |||
HOOC-COOH
| ||||
| 2KMnO4+5H2C2O4+3H2SO4═KSO4+2MnSO4+10CO2↑2O |
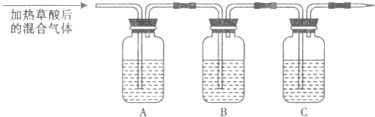
| 仪器 | A | B | C |
| 加入试剂 | NaOH溶液 |
| 滴定前均为 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 20.02mL | 21.00mL | 19.98mL |
①用pH试纸鉴别浓硫酸与浓硝酸
②用硝酸银溶液区分二氧化氮和溴蒸气
③酒精灯被碰倒洒出酒精着火时,迅速用湿抹布扑盖
④用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
⑤温度计被摔坏导致水银散落到地面上,应立即用水冲洗水银
⑥称量NaOH固体时,把NaOH固体放在有滤纸的托盘上称量
⑦为了提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化
⑧检验氯代烃中的氯元素时,可先加氢氧化钠溶液并加热,再加入硝酸银溶液来进行检验
(2)实验室中利用电石和水反应制取一定量乙炔来进行其性质实验(通入溴水、酸性KMnO4溶液),最后点燃(如下图)。完成下列问题:

①制取乙炔的化学方程式为:__________________________________________。
②实验前,应检查气体发生装置(如上图虚线框内装置)的气密性。某同学用双手捂住烧瓶,把导气管伸入水面下,但无任何气泡冒出,则出现此现象的原因可能是___________(填代号)。
A.没有关闭分液漏斗的活塞
B.橡皮塞上的孔与导管不匹配或橡皮塞与分液漏斗不匹配
C.导管伸入水面下太深
D.烧瓶容积较大
③实验室用上图方法点燃乙炔,由于乙炔在空气中燃烧会产生浓烈的黑烟,所以在实验时点燃后要迅速熄灭火焰。试用一种简单的、安全的操作方法熄灭火焰:_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com