
题目列表(包括答案和解析)
| NaOH溶液 |
| 稀硫酸 |
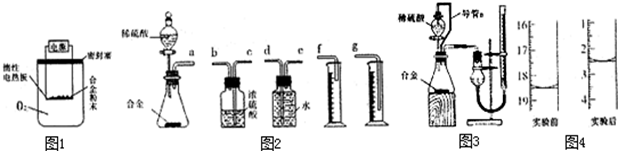
 含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.
含镁3%~5%的铝镁合金是轮船制造、化工生产、机械制造等行业的重要材料.现有一块质量为m g的铝镁合金,欲测定其中镁的质量分数,几位同学设计了不同的实验方案.| 过量盐酸 |
| 过量NaOH溶液 |
| 过量盐酸 |
| 过量NaOH溶液 |
| 3W2 |
| 5m |
| 3W2 |
| 5m |
| () |
| NaOH溶液 |
| 盐酸 |

 问题讨论:
问题讨论: 测定剩余固体质量
测定剩余固体质量 测定生成气体的体积实验装置:
测定生成气体的体积实验装置:
请按要求回答下列问题:
(1).某合作学习小组讨论辨析以下说法,其中说法正确的是 _____________
A根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
B 将Na2O2投入FeCl2溶液中, 可观察到的现象是生成红褐色沉淀、有气泡产生
C 金属元素的原子只有还原性,离子只有氧化性
D不锈钢和目前流通的硬币都是合金;
E NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
(2)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为_____________
(3)在K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O反应中,
氧化剂是_____ _(填化学式) 当有14.6gHCl被氧化时,电子转移为 mol。
(4)学校研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列实验方案进行探究,填写下列空白:
实验方案:铝镁合金 ![]()
![]() 测定剩余固体质量。
测定剩余固体质量。
① 实验中发生反应的化学方程式是__________________。
② 实验步骤:称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol/L NaOH 溶液中充分反应。计算所用NaOH溶液的体积V≥______________。
过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________( 填 不变 偏高 或 偏低 )。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com