
题目列表(包括答案和解析)
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B = C + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
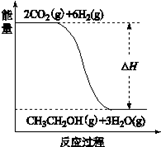
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
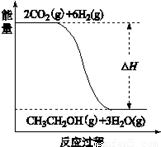
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H = a KJ/mol,当消耗标况下5.6 L CO2时的反应热 △H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
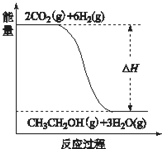
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
在1×105Pa和298K时,将拆开1mol共价键所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:
|
共价键 |
H-H |
N≡N |
N-H |
|
键能(kJ·mol-1) |
436 |
945 |
391 |
(1)根据上表中的数据判断工业合成氨的反应:N2+3H2 2NH3是___________(填“吸热”或“放热”)反应;
2NH3是___________(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应,若氮气和氢气完全反应,理论上放出或吸收的热量为Q1,则Q1为__________;
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是 ( )
A. Q1>Q2 B. Q1<Q2 C. Q1=Q2
如此选择的理由_________________________________________________;
⑷.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充人1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 2NH3。下列有关说法正确的是_______________________.
2NH3。下列有关说法正确的是_______________________.
A.达到化学平衡时,正反应和逆反应的速率都为零。
B.当符合:3u正(N2)=u正(H2)时,反应达到平衡状态。
C.达到化学平衡时,单位时间消耗amolN2,同时生成3amolH2
D.反应达到平衡状态,最多可生成氨2 mol。
E. 工业合成氨,我们希望提高反应物的转化率并加快反应速率。
F.氨分子内形成氢键,使氨的沸点升高.
G.氮分子的分子间作用力大,使氮分子化学性质很稳定.
H.氢能源属于化石能源.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com