
题目列表(包括答案和解析)
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定
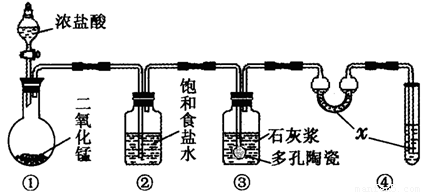
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是
_________________________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
|
滴定次数 |
1 |
2 |
3 |
|
KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为 。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将 (填“偏高”、“偏低”或“无影响”)
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定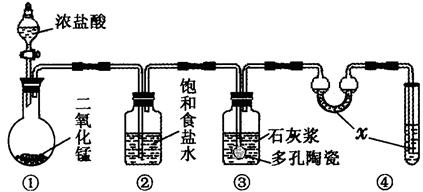
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是
_________________________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |

| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后,收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e- =2Cl- 。
回答问题:
(1)试写出①有关的离子方程式:________________________________________________。
(2)请配平②的化学方程式:
____KMnO4+____HCl -______KCl+ _____MnCl2+_____Cl2↑+____ H2O
通过对第②段文字中提供的数据进行计算可得出:a +b的最大值为 ____ ,a +b最小值为_____。
(3)下列四种物质中能使③中的还原过程发生的物质是________。
A.Na2CO3 B.KMnO4 C.XeO3 D.Na2SO3
将该反应的氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥表示电子转移的方向和数目: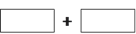
仔细阅读下列三段文字
①由稀有气体元素Xe(氙)与氧元素形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入含Mn2+的水溶液中,溶液逐渐变为紫红色且pH不断减小。
②将0.08 mol KMnO4固体(质量为12.64 g)加热一段时间后,收集到a mol O2;向反应后残留的固体中加入足量的浓盐酸,又收集到b mol Cl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
③氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:Cl2+2e- =2Cl- 。
回答问题:
(1)试写出①有关的离子方程式:________________________________________________。
(2)请配平②的化学方程式:
____KMnO4+____HCl -______KCl+ _____MnCl2+_____Cl2↑+____ H2O
通过对第②段文字中提供的数据进行计算可得出:a +b的最大值为 ____ ,a +b最小值为_____。
(3)下列四种物质中能使③中的还原过程发生的物质是________。
| A.Na2CO3 | B.KMnO4 | C.XeO3 | D.Na2SO3 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com