28、为探究CO
2的化学性质,需要制取并收集干燥的CO
2,以下是老师提供的一些实验装置.
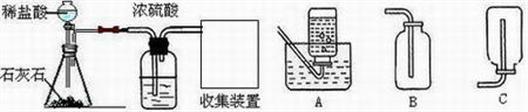
(1)实验室制取CO
2的化学方程式为_
CaCO3+2HCl═CaCl2+H2O+CO2↑
_;
(2)浓硫酸的作用是
干燥二氧化碳气体
,收集装置为
B
(填字母);
(3)学校实验室的废液缸中收集了同学们在实验室制取二氧化碳的废液.小溪同学想探究废液中溶质的成分,请你共同参与探究,并回答下列问题:
【提出问题】废液中的溶质是什么物质?
【做出猜想】小溪认为废液中溶质只有氯化钙.
你认为还可能含有的溶质是
HCl
(填化学式);
【查阅资料】氯化钙溶液呈中性.
【实验与结论】
①小溪分别取少量该废液和氯化钙溶液加入到两支试管中,并向其中分别滴入无色酚酞试液作对比实验,结果两支试管中溶液均为无色,于是小溪认为自己的猜想是正确的.
②你认为小溪的实验
不能
(填“能”或“不能”)证明她的猜想,理由是
酚酞遇盐酸也不变色,无法确定是否含有HCl
.
③如果要证明你的猜想是正确的,你选择的试剂是
紫色石蕊试液或碳酸钠溶液或较活泼的金属
,试验中可以看到的实验现象是
溶液变红或产生气泡
.
【拓展与应用】
①若实验证明你的猜想是正确的,要想使处理后的废液只有氯化钙溶液,应向废液中加入过量的
石灰石(或CaCO3粉末
,反应完成后静置过滤,得到纯净的氯化钙溶液.
②通过以上探究,你认为实验室的废液未经处理直接倒入下水道,可能造成的危害是
可能腐蚀管道或者污染水质等
.(写一条)



