
题目列表(包括答案和解析)
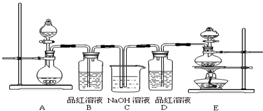
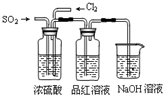
 某中学化学兴趣小组对乙醇的分子结构进行探究,
某中学化学兴趣小组对乙醇的分子结构进行探究,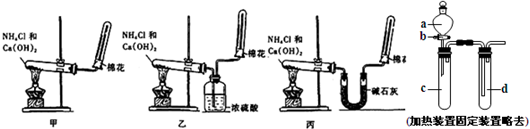
| ||
| ||
| ||
| ||
| 53(b-a) |
| 22a |
| 53(b-a) |
| 22a |
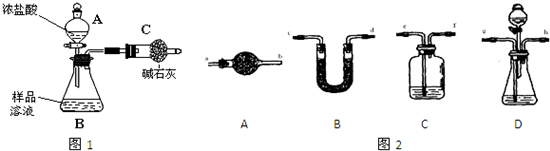
| 选用的仪器 | C C |
D D |
C C |
B B |
A A |
| 添加的药品 (必要的操作) |
装有氢氧化钠溶液,从e通入空气 装有氢氧化钠溶液,从e通入空气 |
分液漏斗装稀硫酸,锥形瓶内装样品溶液 分液漏斗装稀硫酸,锥形瓶内装样品溶液 |
浓硫酸 浓硫酸 |
碱石灰,反应前后分别称量质量 碱石灰,反应前后分别称量质量 |
碱石灰 碱石灰 |

| m2-w2 |
| 2w |
| m2-w2 |
| 2w |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com