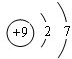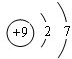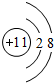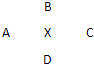
ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X
2O
5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
(1)各元素的符号:
A:
Si
Si
,B:
N
N
,C:
S
S
,D:
As
As
,X:
P
P
.
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:
H2SO4>H3PO4>H3AsO4
H2SO4>H3PO4>H3AsO4
.
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:
NH3>PH3>SiH4
NH3>PH3>SiH4
.
ⅡFe
3+和I
-在水溶液中的反应如下:2I
-+2Fe
3+?2Fe
2++I
2(水溶液),
(1)该反应的平衡常数K的表达式为:K=
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
.
[物质的浓度用“c(物质)”表示].当上述反应达到平衡后,加入CCl
4萃取I
2,且温度不变,上述平衡
向右
向右
移动(填“向右”、“向左”、“不”).
(2)上述反应的正向反应速率和I
-、Fe
3+的浓度关系为:v=K[c(I
-)]
m[c(Fe
3+)]
n(其中K为常数)
|
c(I-)(mol/L) |
c(Fe3+)(mol/L) |
v[mol/(L?s)] |
| (1) |
0.20 |
0.80 |
0.032K |
| (2) |
0.60 |
0.40 |
0.144K |
| (3) |
0.80 |
0.20 |
0.128K |
通过所给的数据计算得知:
①在v=K[c(I
-)]
m[c(Fe
3+)]
n中,m、n的值为
C
C
.
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I
-浓度对反应速率的影响
>
>
Fe
3+浓度对反应速率的影响(填“>”、“<”或“=”).

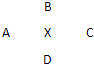 ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定: