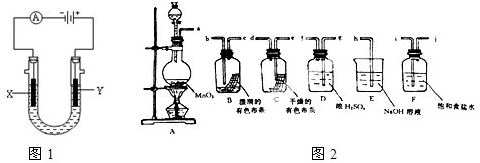
Ⅰ.工业上常用电解饱和食盐水的方法制备氯气,其装置如图1所示,如果在饱和食盐水中滴加酚酞,通电后
X
X
(填X或Y)极附近溶液变红,写出电解饱和食盐水的化学方程式
.再用氯气制备漂白粉,请写出漂白粉长期露置在空气中失效的反应的化学方程式
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.
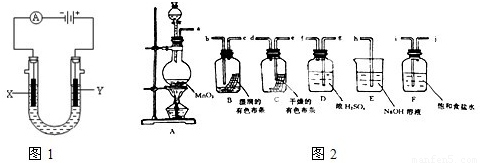
Ⅱ.请利用图2装置及试剂组装一套装置,其流程是先制取纯净干燥的Cl
2(不收集),后试验干燥的Cl
2和潮湿的Cl
2有无漂白性.
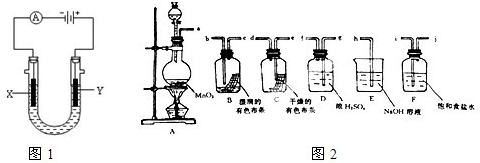
(1)按气体从左向右流向将各装置依次连接起来(填接口标号):a 接
i
i
,
j
j
接
g
g
,
f
f
接
e
e
,
d
d
接
b
b
,
c
c
接
h
h
.
(2)圆底烧瓶中发生反应的化学方程式是
MnO
2+4Hl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4Hl(浓)
MnCl
2+Cl
2↑+2H
2O
.如果将过量二氧化锰与20mL 12mol?L
-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因为
反应一段时间后,盐酸浓度变稀,不能和二氧化锰就反应
反应一段时间后,盐酸浓度变稀,不能和二氧化锰就反应
.
(3)E装置的作用是
除去多余的氯气,防止污染空气
除去多余的氯气,防止污染空气
,F装置的作用是
除去氯气中的氯化氢
除去氯气中的氯化氢
.
(4)装置
B
B
(填“B”或“C”)中的有色布条褪色,以上事实说明起漂白作用的物质是
次氯酸
次氯酸
.

 工业上电解饱和食盐水可得到多种工业原料,其中氢气和氯气用途非常广泛.
工业上电解饱和食盐水可得到多种工业原料,其中氢气和氯气用途非常广泛.