某学生用0.2000mol?L
-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)
①
①
,若测定结果偏高,其原因可能是
AD
AD
.
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:
锥形瓶中溶液由无色变为浅红色,半分钟不褪色;
锥形瓶中溶液由无色变为浅红色,半分钟不褪色;
.
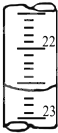
(3)如图1是某次滴定时的滴定管中的液面,其读数为
22.60
22.60
mL.

(4)排去碱式滴定管中气泡的方法应采用图2中的
丙
丙
操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(5)根据下列数据:请计算待测盐酸溶液的浓度:
0.2000
0.2000
mol/L.
| 滴定次数 |
待测体积(mL) |
标准烧碱体积(mL) |
| 滴定前读数 |
滴定后读数 |
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
2.00 |
21.80 |
| 第三次 |
20.00 |
4.00 |
24.20 |


 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:①用蒸馏水洗涤碱式滴定管,并直接注入NaOH溶液至“0”刻度线以上
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步: