
题目列表(包括答案和解析)

某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
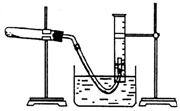
①检查装置气密性
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
③装好实验装置。
④加热,开始反应,直到产生一定量的气体
⑤停止加热,测量收集到气体的体积
⑥准确称量试管和残留物的质量为b g。
⑦测量实验室的温度。
⑧处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性? 。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3)如果实验中得到的氧气体积是cL(25℃、1.0l×l05Pa,该条件下气体的摩尔体积为Vm).氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
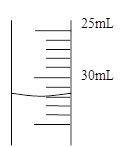 (4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(5)若计算所得结果比实际值偏大,则可能的原因是___________
A.氯酸钾中混有不产生氧气的固体杂质
B.第一次称量时药品、砝码反置
C.药品未完全分解
D.量筒内液体被排尽
E.装置漏气
F.读数时俯视量筒刻度
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
①检查装置气密性
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
③装好实验装置。
④加热,开始反应,直到产生一定量的气体
⑤停止加热,测量收集到气体的体积
⑥准确称量试管和残留物的质量为b g。
⑦测量实验室的温度。
⑧处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性? 。
(2)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量筒内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3)如果实验中得到的氧气体积是cL(25℃、1.0l×l05Pa,该条件下气体的摩尔体积为Vm).氧气的摩尔质量的计算式为(含a、b、c,不必化简):M(O2)= 。
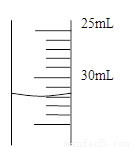 (4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(4)若50mL量筒内液面如右图所示,则所测得气体的体积约为____________________mL.
(5)若计算所得结果比实际值偏大,则可能的原因是___________
A.氯酸钾中混有不产生氧气的固体杂质
B.第一次称量时药品、砝码反置
C.药品未完全分解
D.量筒内液体被排尽
E.装置漏气
F.读数时俯视量筒刻度
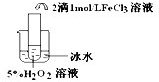
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
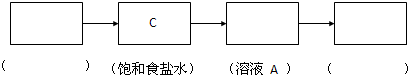
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com