
题目列表(包括答案和解析)





| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.28 | 0.86 | 0.86 |
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3;2SO2(g)+O2(g)![]() 2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
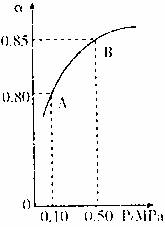
①平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列选项中有利于提高SO2平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.移出氧气
③SO2尾气用Na2SO3溶液吸收可得到重要化工原料,反应的化学方程式为
;上述反应产物的水溶液呈酸性,原因 。
④工业制硫酸中SO2的一种制法是煅烧FeS2制取,煅烧FeS2的产物之一Fe3O4溶于H2SO4后,加入Fe粉可制取FeSO4,酸溶过程需保持溶液足够酸性,其原因是
。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2的整个过程中转移的电子总数为
(阿伏加德罗常的值用NA表示),写出上述反应的热化学方程式:
。
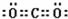
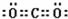
| 1 |
| 2 |
| 1 |
| 2 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com