
题目列表(包括答案和解析)
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |

一、配制0.100 mol·L-1 AgNO3溶液
准确称取AgNO3
二、0.100 mol·L-1 AgNO3溶液的标定
准确称取
取上述溶液25.00 mL 3份,分别置于锥形瓶中,加25 mL水,1 mL 5%K2CrO4溶液,在不断摇动下用AgNO3溶液滴定,至溶液呈砖红色〔2Ag++![]()
![]() Ag2CrO4↓(砖红色)〕。实验测得三次所耗硝酸银溶液体积的平均值为26.32 mL。
Ag2CrO4↓(砖红色)〕。实验测得三次所耗硝酸银溶液体积的平均值为26.32 mL。
三、氯化物试样中氯的测定
准确移取25.00 mL氯化物试液3份,分别置于锥形瓶中,加入25 mL水,1 mL 5% K2CrO4溶液,在不断摇动下用AgNO3标准溶液滴定至溶液呈砖红色。实验测得三次所耗硝酸银溶液的体积的平均值为13.16 mL。
回答下列问题:
(1)NaCl固体使用前,都要将其置于坩埚中加热,并用____________不断搅拌,待爆裂声停止后继续加热15分钟,稍冷后,再将坩埚放入干燥器中冷至室温备用。如此操作的主要目的是__________________________________。
(2)AgNO3溶液需要标定的主要原因是_________________________________________。
(3)指示剂![]() 在溶液中存在下列平衡:2H++2
在溶液中存在下列平衡:2H++2![]()
![]()
![]()
![]()
![]() +H2O,由此判断该滴定适宜的pH范围可能是____________。(填代号)
+H2O,由此判断该滴定适宜的pH范围可能是____________。(填代号)
A.1—6.5 B.6.5—
(4)用硝酸银滴定氯离子达到化学计量点时,c(Ag+)=c(Cl-),若此时要求不生成Ag2CrO4沉淀,c(![]() )最大不能超过____________ mol·L-1,因此,实验中对指示剂的浓度有较高的要求。(已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.8×10-12)
)最大不能超过____________ mol·L-1,因此,实验中对指示剂的浓度有较高的要求。(已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.8×10-12)
(5)![]() 的黄色对滴定终点的判断没有影响的原因是____________________________。
的黄色对滴定终点的判断没有影响的原因是____________________________。
(6)AgNO3标准溶液的准确浓度为____________ mol·L-1,可溶性氯化物中氯的含量为__________g·L-1。
(7)滴定管用完后,要先用__________洗涤。原因是_______________________________。
2CNO-+3ClO-+2 H+====N2↑+2CO2↑+3Cl-+H2O。某科研部门用图1-5-25所示装置进行模拟实验,以证明上述处理CN-污水方法的有效性,并测定CN-被处理的百分率,下述实验装置通过测定CO2的量来确定CN-的处理效果。
试根据要求完成下列问题:
(1)将浓缩后含CN-的污水(其中CN-浓度为0.50 mol·L-1)20 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。乙装置中生成的气体除含有CO2、N2、HCl外,还有副反应生成的Cl2等物质,写出生成Cl2的副反应的离子方程式:_____________________________________________。
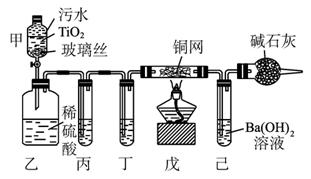
图1-5-25
(2)丙中加入的除杂试剂是_________,丁中的试剂是_________。
A.饱和碳酸氢钠溶液 B.饱和食盐水
C.浓硫酸 D.饱和碳酸钠溶液
(3)戊在实验中的作用是______________________________________________________
____________________________________________________________________。
(4)若己中盛有足量氢氧化钡,实验后己中共生成1.773 g沉淀,则该实验中CN-被处理的百分率为_________ (Ba的相对原子质量为137)。
(5)若己中盛有的氢氧化钡溶液为10 mL,要使CN-完全被氧化,氢氧化钡的物质的量浓度最低为_________ (保留1位小数)。
(6)上述实验中造成戊中碳酸钡质量测定值偏小的可能原因有(写出两点即可) ____________
_____________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com