
题目列表(包括答案和解析)
 +CO2+H2O→
+CO2+H2O→ +NaHCO3;
+NaHCO3; +CO2+H2O→
+CO2+H2O→ +NaHCO3;
+NaHCO3;| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,震荡. | 出现白色浑浊 出现白色浑浊 |
苯酚常温下溶解度不大 苯酚常温下溶解度不大 |
| 步骤2:取少量C的稀溶液分装b、c两只试管,往b试管 滴入过量饱和溴水,振荡. 滴入过量饱和溴水,振荡. |
产生白色沉淀 | 苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. 苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. |
| 步骤3:往c试管 滴入几滴FeCl3溶液,振荡 滴入几滴FeCl3溶液,振荡 |
溶液变为紫色 溶液变为紫色 |
C与加入的试剂发生显色反应. |
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
- 3 |
2- 3 |
2- 6 |

| ||
| ||
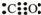
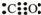
 F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)| 编号 | 金属(粉末状) | 物质量 | 酸浓度 酸体积 |
反应温度 |
| A | Al | 0.1mol | 2mol?L-1 盐酸 10mL |
60℃ |
| B | Fe | 0.1mol | 1mol?L-1 盐酸 10mL |
30℃ |
| C | Mg | 0.1mol | 1mol?L-1 盐酸 10mL |
60℃ |
| D | Mg | 0.1mol | 1mol?L-1 硫酸 10mL |
60℃ |
| A、A | B、B | C、C | D、D |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com