
题目列表(包括答案和解析)
| ||
| ||
| △ |
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 |
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
(16分)氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:______________。
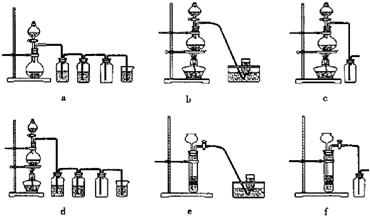
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。
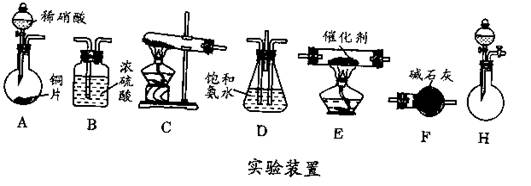
Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
|
试剂组合序号 |
固体试剂/g |
NH3体积/mL |
|
a |
12.0g Ca(OH)2(过量) 10.8g NH4Cl |
2688 |
|
b |
12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 |
2728 |
|
c |
12.0g NaOH(过量) 10.8g NH4Cl |
3136 |
|
d |
12.0g NaOH(过量) 10.8g (NH4)2SO4 |
3118 |
|
e |
12.0g CaO(过量) 10.8g NH4Cl |
3506 |
|
f |
12.0g CaO(过量) 10.8g (NH4)2SO4 |
3584 |
分析表中数据,实验室制NH3产率最高的是:___________________(填序号),其他组合NH3产率不高的原因是:____________。
Ⅲ.模拟尾气的处理。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:

①A中反应的离子方程式:_________。
②D装置作用除使气体混合均匀和调节气流速度以外,还有一个作用是_____________。
③D装置中的液体可换成_________(填序号)。
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是________________。
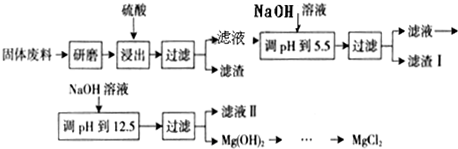
(1)该同学准备了下列实验用品:20%NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)该同学查阅有关资料知:氧气在液滴的表面和中心浓度不同;Fe2+遇K3[Fe(CN)6]产生蓝色沉淀:3Fe2++2[Fe(CN)6]3-====Fe3[Fe(CN)6]2↓(蓝色)。该同学在一块光洁无锈的铁板上滴2滴含酚酞和K3[Fe(CN)6]的NaCl溶液,在空气中放置几分钟后,发现盐水滴
边缘溶液显红色,盐水与铁板的接触面中心出现蓝色不溶物(见图示)。
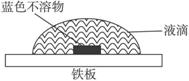
试判断该实验是否是铁的吸氧腐蚀。
若是,请写出正极反应方程式:___________________________________________________。
若否,指出产生该现象的原因:___________________________________________________。
(3)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下面两项中择一回答:
①若不是原电池,请说明原因:_________________(如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是_________________。
(4)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:
_____________________________________________________________________。
(16分)氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:_ _____________。
_____________。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。
Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
| 试剂组合序号 | 固体试剂/g | NH3体积/mL |
| a | 12.0g Ca(OH)2(过量) 10.8g NH4Cl | 2688 |
| b | 12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 (OH)2(过量) 10.8g(NH4)2SO4 | 2728 |
| c | 12.0g NaOH(过量) 10.8g NH4Cl | 3136 |
| d | 12.0g NaOH(过量) 10.8g (NH4)2SO4 | 3118 |
| e | 12.0g CaO(过量) 10.8g NH4Cl | 3506 |
| f | 12.0g CaO(过量) 10.8g (NH4)2SO4 | 3584 |

 ____________。
____________。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com