
题目列表(包括答案和解析)
① | 溶解 | 将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解 |
② | 沉淀 | 逐渐加入氢氧化钠溶液,直至不再出现沉淀为止 |
③ |
|
|
④ |
|
|
⑤ | 过滤 | 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤 |
⑥ |
|
|
⑦ |
|
|
实验目的:粗盐提纯,得到纯净氯化钠晶体
实验用品:(1)药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。
(2)仪器:略
(不必叙述如何组装实验装置)实验问题讨论
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①__________________________________________________________________。
②__________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是____________________。
已除去泥沙的粗盐中,仍含有Mg2+、Ca2+和![]() ,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
,请填写下表中的空格,完成将粗盐提纯,得到氯化钠晶体的实验设计。
| ① | 溶解 | 将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解 |
| ② | 沉淀 | 逐渐加入氢氧化钠溶液,直至不再出现沉淀为止 |
| ③ | ||
| ④ | ||
| ⑤ | 过滤 | 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤 |
| ⑥ | ||
| ⑦ |
实验目的:粗盐提纯,得到纯净氯化钠晶体
实验用品:(1)药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。
(2)仪器:略
(不必叙述如何组装实验装置)实验问题讨论
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①_______________________________________________________________________。
②______________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是____________________。
① | 溶解 | 将粗盐放入烧杯中,加入适量的蒸馏水,充分搅拌,直至固体全部溶解 |
② | 沉淀 | 逐渐加入氢氧化钠溶液,直至不再出现沉淀为止 |
③ |
|
|
④ |
|
|
⑤ | 过滤 | 安装好过滤器,将④烧杯中的悬浊液沿玻璃棒加入过滤器中过滤 |
⑥ |
|
|
⑦ |
|
|
实验目的:粗盐提纯,得到纯净氯化钠晶体
实验用品:药品:粗盐、NaOH溶液、HCl溶液、Na2CO3溶液、BaCl2溶液、pH试纸和蒸馏水。仪器:略
(不必叙述如何组装实验装置)实验问题讨论:
(1)甲同学在多次过滤后,发现烧杯中的滤液仍浑浊,分析他的操作不当的原因可能是:
①__________________________________________________________________。
②__________________________________________________________________。
(2)乙同学过滤后,滤液是澄清的,当取少量蒸发后的氯化钠晶体溶于水滴加硫酸钠溶液时,却出现白色沉淀。分析乙在实验步骤设计上存在的问题可能是________________________。
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。某校化学研究性学习小组为探究草酸的部分性质,进行了如下实验:
(1)为比较相同浓度的草酸和硫酸的导电性,实验室需配制100 mL 0.1mol/L的草酸溶液,配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒、_____ 、____。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。请你按整套装置从左至右的顺序填写下表中的空格:


①请写出乙二酸受热分解的化学方程式 _______。
②上述实验中能说明乙二酸热分解生成了还原性气体的实验现象是____。
③检验乙二酸具有较强的还原性,通常选用的试剂是____。
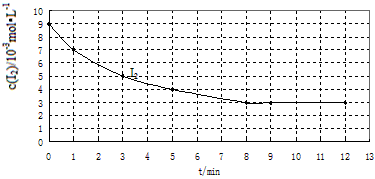
 2HI (g) △H<0 反应速率的影响,设计下表所示实验
2HI (g) △H<0 反应速率的影响,设计下表所示实验
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com