
题目列表(包括答案和解析)

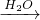 CuCl↓+Cl-.
CuCl↓+Cl-.SO2和NOx的排放是造成酸雨的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
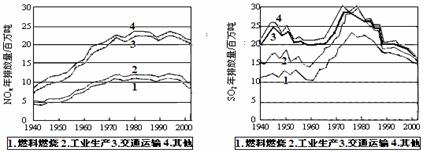
(1)结合上图数据,判断下列说法正确的是 ▲ 。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
▲ 。
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO ![]() N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
在上述条件下反应能够自发进行,则反应的![]() ▲ 0(“>”、“<”、“=”)。在该温度下,反应的平衡常数K= ▲ 。
▲ 0(“>”、“<”、“=”)。在该温度下,反应的平衡常数K= ▲ 。
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62 [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请计算排放在空气中的NOx和SO2的物质的量之比接近于 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com