
题目列表(包括答案和解析)
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A.在铜与硫的反应中,1 mol铜参加反应失去的电子数目为2NA |
| B.1.5 molNO2与足量H2O反应,转移的电子数为2NA |
| C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
| D.0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA |
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
A.在铜与硫的反应中,1 mol铜参加反应失去的电子数目为2NA
B.1.5 molNO2与足量H2O反应,转移的电子数为2NA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
D.0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA
| A.在铜与硫的反应中,1 mol铜参加反应失去的电子数目为2NA |
| B.1.5 molNO2与足量H2O反应,转移的电子数为2NA |
| C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
| D.0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA |
化学实验是研究物质性质的基础.
(1)下列有关实验操作或测量数据合理的是________(填序号).
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定的Na+、CO32-、SO32-,甲、乙两研究小组欲测定其中SO32-离子的浓度.
![]()
甲组方案:
试剂X从下列试剂中选择:
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 NaOH溶液
c.新制氯水d.KI溶液
①加入的试剂X为________(填字母序号),生成SO42-主要的离子方程式为________.
②甲组方案中,第ⅲ步的“系列操作”包含的操作名称各为________.
乙组方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水的杂色;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1 KMnO4(H2SO4酸化)溶液进行滴定:(有关反应为:2MnO4-+5SO32-+6H+![]() 2Mn2++5SO42-+3H2O)
2Mn2++5SO42-+3H2O)
ⅲ.记录数据,计算.
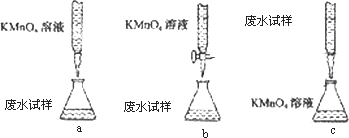
③乙组设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)
(3)某同学制备Fe(OH)3胶体:用洁净烧杯量取适量蒸馏水加热至沸腾,向烧杯中缓慢滴加饱和的FeCl3溶液,并不断用玻璃棒搅拦,结果溶液变浑浊.该同学制备胶体失败的原因是________,你认为成功制得Fe(OH)3胶体的特征现象是________.
(4)用下图装置进行CO2性质的有关实验.
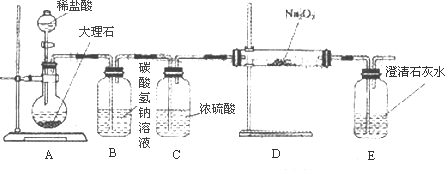
①试剂瓶B中盛有饱和NaHCO3溶液,其目的是________.
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系________.
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5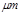 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
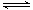 2NO(g) △H
2NO(g) △H 0
0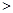 0,判断该设想能否实现并简述其依据: 。
0,判断该设想能否实现并简述其依据: 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com