
题目列表(包括答案和解析)
[ ]
A.强酸性 B.强氧化性 C.脱水性 D.吸水性
(10分) 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。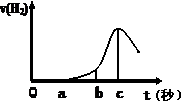
(1)关于图像的描述不正确的是 (填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为 mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;② ;

下列有关金属的描述,正确的是( )
A.Cu和S在加热的条件下反应可生成CuS
B.金属铁和铝都可以被浓硫酸钝化,因此铁和铝都不能与浓硫酸反应
C.等质量的金属铝,分别和足量的稀硫酸和氢氧化钠溶液反应,所得氢气一样多
D.除去镀在铝表面的铜镀层,最佳试剂是稀硝酸
下列有关金属的描述,正确的是( )
A.Cu和S在加热的条件下反应可生成CuS
B.金属铁和铝都可以被浓硫酸钝化,因此铁和铝都不能与浓硫酸反应
C.等质量的金属铝,分别和足量的稀硫酸和氢氧化钠溶液反应,所得氢气一样多
D.除去镀在铝表面的铜镀层,最佳试剂是稀硝酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com