
题目列表(包括答案和解析)
设阿伏加德罗常数为NA。则下列说法正确的是:
A.常温常压下,6 g ![]() He所含有的中子数目为2NA
He所含有的中子数目为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
(14分)设计一个实验,能通过观察到的明显现象,说明CO2与NaOH溶液发生了反应。实验用品:集气瓶、烧瓶、分液漏斗、导管、橡皮管、弹簧夹、烧杯、量筒、水、CO2气体、NaOH溶液以及你认为所能用到的仪器和药品。现有五位同学设计了如图A—E五个装置,试回答: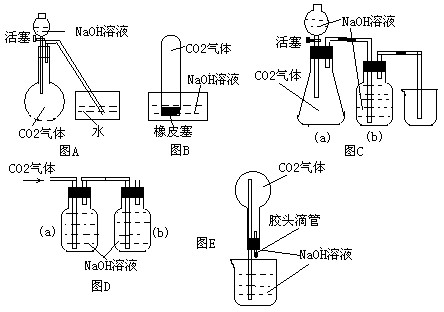
(1)对图A,当将分液漏斗中的NaOH溶液滴入烧瓶时,如果看到水槽中的水被吸入到烧瓶中,则证明CO2与NaOH溶液发生了反应。请写出NaOH溶液与过量CO2反应的化学方程式:
(2)若用100mL 1mol/LNaOH溶液吸收0.06 mol CO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比为 。
(3)设NA为阿伏加德罗常数,下列关于0.2mol/L的Na2CO3溶液说法不正确的是
A.2L溶液中阴阳离子总数为0.8NA
B.500mL溶液中CO32-离子浓度为0.2mol/L
C.500mL溶液中Na+离子浓度为0.2mol/L
D.500mL溶液中CO32-物质的量为0.4NA
(4)对图B—E,请指出能达到实验目的的装置 (用B、C、D、E填空),并选出其中两种,说明能证明CO2与NaOH溶液发生了反应的操作及实验现象,将结果填入下表:
所选装置 | 操作方法 | 实验现象 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com