
题目列表(包括答案和解析)
| X | Y | Z |
| 甲 | 乙 | 丙 |
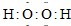
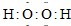
| ||
| ||
 A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:
A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:(14分)A、B、C、D、E 五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3∶4,E原子的电子层数等于最外层电子数,D的原子序数小于E。请用化学用语回答相关问题:
(1)A元素在周期表中的位置 。
(2)比较C和E简单离子半径大小: 。
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示): ;
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体。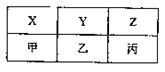
①甲的分子式为 ;丙的电子式为 。
②乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式: 。
(14分)A、B、C、D、E五种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3∶4,E原子的电子层数等于最外层电子数,D的原子序数小于E。请用化学用语回答相关问题:
(1)A元素在周期表中的位置 。
(2)比较C和E简单离子半径大小: 。
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示): ;
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成的化合物,六种化合物可以排成下表,其中同一横行的分子中电子数相同,同一纵行的物质所含元素种类相同,其中X、Y、甲常温常压下为气体,Z、乙、丙常温常压下为液体。
①甲的分子式为 ;丙的电子式为 。
②乙的分子式为B2D4,乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时,放出热量为160.35kJ,试写出该反应的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com