
题目列表(包括答案和解析)
| 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PC15为例)如下图所示。该结构中氯原子有两种不同位置。 |
 |
| (1)6.20 g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为____L。 上述燃烧产物溶于水配成50.0 mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为____ mol·L-1 (2)含0.300 mol H3PO4的水溶液滴加到含0.500 mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g H2O。该难溶盐的化学式可表示为____。 (3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBrx(1≤x≤4,且x为整数)。如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为____。 (4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10 mol PCl5和0.10mol NH4Cl恰好完全反应,生成氯化氢和0.030 mol 磷腈化合物。推算磷腈化合物的相对分子质量(提示:M> 300)。 |
| 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PC15为例)如下图所示。该结构中氯原子有两种不同位置。 |
 |
| (1)6.20 g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为____L。 上述燃烧产物溶于水配成50.0 mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为____ mol·L-1 (2)含0.300 mol H3PO4的水溶液滴加到含0.500 mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g H2O。该难溶盐的化学式可表示为____。 (3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBrx(1≤x≤4,且x为整数)。如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为____。 (4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10 mol PCl5和0.10mol NH4Cl恰好完全反应,生成氯化氢和0.030 mol 磷腈化合物。推算磷腈化合物的相对分子质量(提示:M> 300)。 |

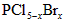 (
(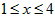 ,且x为整数)。如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为___________。
,且x为整数)。如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为___________。
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
根据上述数据问题.
(1)下列物质本身具有的能量最低的是________(填序号)
A.H2
B.Cl2
C.Br2
D.I2
化合物HCl、HBr、HI中________受热时最稳定.
(2)1 mol H2在2 mol Cl2中燃烧,放出热量________kJ.一定条件下,1 mol H2分别与足量Cl2、Br2、I2反应,放出热量由多到少的顺序是________(填序号)
A.Cl2<Br2<I2
B.Cl2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是________(填序号)
①原子或分子间的相互作用叫化学键
②氯分子中两个氯原子间的距离是键长
③键长的大小与成键原子的半径和成键数目有关
④键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是________(填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似.
①写出(CN)2与苛性钠溶液反应的离子方程式________;
②已知氰分子中键与键之间的夹角为180°,并有对称性,则结构式为________.
③氰分子中碳原子为________杂化;一个氰分子中包含________个σ键,________个键.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com