Ⅰ.下列有关实验操作中,合理的是
C
C
(填序号).
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H
2SO
4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是
用标准盐酸润洗2-3次
用标准盐酸润洗2-3次
.
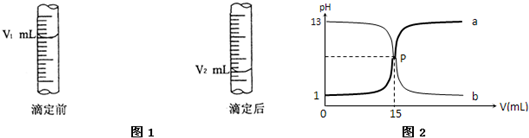
(2)图1是酸式滴定管中液面在滴定前后的读数:c (NaOH)=
mol/L.

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度
偏大
偏大
.(选“偏大”“偏小”“不变”)
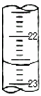
III.如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
曲线a是用
NaOH
NaOH
溶液滴定
HCl
HCl
溶液;曲线b是用
HCl
HCl
溶液滴定
NaOH
NaOH
溶液;P点的坐标为
(15,7)
(15,7)
;盐酸的物质的量浓度为
0.1
0.1
mol/L.


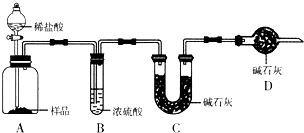 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.