
题目列表(包括答案和解析)
在一定温度和催化剂条件下,某一密闭容器内发生可逆反应:2A(g) + B(s) ![]() 2C(g),下列有关叙述中错误的是
2C(g),下列有关叙述中错误的是
![]() A.达到平衡状态时,c[A(g)]和c[C(g)]一定相等
A.达到平衡状态时,c[A(g)]和c[C(g)]一定相等
![]() B.在上述条件下,A(g) 不可能100%地转化为C(g)
B.在上述条件下,A(g) 不可能100%地转化为C(g)
![]() C.将块状的B改为粉末能使反应速率加快
C.将块状的B改为粉末能使反应速率加快
![]() D.使用合适的催化剂是为了提高生产的效率
D.使用合适的催化剂是为了提高生产的效率
|
在一定温度和催化剂条件下,某一密闭容器内发生可逆反应:2A(g)+B(s) | |
| [ ] | |
A. |
达到平衡状态时,cA(g)和cC(g)一定相等 |
B. |
在上述条件下,A(g)不可能100%地转化为C(g) |
C. |
将块状的B改为粉末能使反应速率加快 |
D. |
使用合适的催化剂是为了提高生产的效率 |
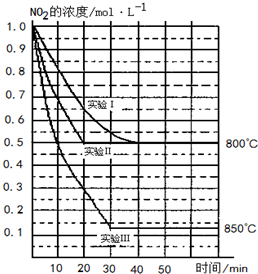 某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)
某条件下,在2L密闭容器中发生如下反应2NO2(g)?2NO(g)+O2(g)| c(NO)2×c(O2) |
| c(NO2)2 |
| c(NO)2×c(O2) |
| c(NO2)2 |
(14分)向某密闭容器中加入0.6molA、0.2molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示(其中t0-t1阶段c(B)未画出)。乙图为反应体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件(催化剂、温度、浓度、压强,每次改变条件均不同),已知t3~t4阶段为使用催化剂。
(1)若t1=5s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________mol/(L•s)。
(2)若t2~t3阶段,C的体积分数变小,此阶段v(正)___v(逆)(填“>”、“=”或“<”)。
(3)t4~t5阶段改变的条件为_______,B的起始物质的量为_______。
(4)t5~t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式:__________________________________。
(5)该反应的化学平衡常数K可表示为_______________。[用含c(A)、c(B) 、c(C)的式子表示]
并在下图中补画出t1~t6 各阶段K的变化趋势图像
(14分)向某密闭容器中加入0.6molA、0.2molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示(其中t0-t1阶段c(B)未画出)。乙图为反应体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件(催化剂、温度、浓度、压强,每次改变条件均不同),已知t3~t4阶段为使用催化剂。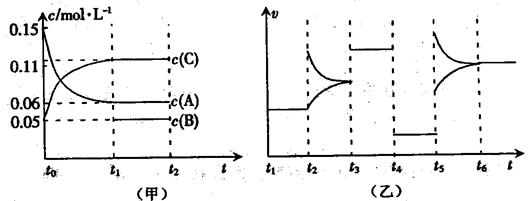
(1)若t1=5s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________mol/(L?s)。
(2)若t2~t3阶段,C的体积分数变小,此阶段v(正)___v(逆)(填“>”、“=”或“<”)。
(3)t4~t5阶段改变的条件为_______,B的起始物质的量为_______。
(4)t5~t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式:__________________________________。
(5)该反应的化学平衡常数K可表示为_______________。[用含c(A) 、c(B) 、c(C)的式子表示]
并在下图中补画出t1~t6 各阶段K的变化趋势图像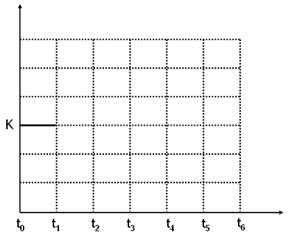
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com