实验:
(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
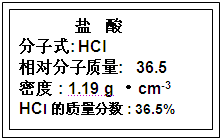
①该浓盐酸中HCl的物质的量浓度为
11.9
11.9
mol?L
-1.②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
BD
BD
.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl
-的数目 D溶液的密度
(2)实验室配制480mL0.08mol/LNa
2CO
3溶液回答下列问题
①应用托盘天平称取十水碳酸钠晶体
11.4
11.4
g
②若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是
10.6
10.6
g(1g以下用游码)
③用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是
B
B
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
④若实验遇下列情况,溶液的浓度是“偏高”、“偏低”还是“不变”?
A.加水时越过刻度线
偏低
偏低
;
B.忘记将洗涤液加入容量瓶
偏低
偏低
;
C.容量瓶内壁附有水珠而未干燥处理
不变
不变
;
D.溶解后没有冷却便进行定容
偏高
偏高
.
(3)①取少量Fe
2O
3粉末(红棕色)加入适量盐酸,反应的离子方程式为
Fe2O3+6H+=2Fe3++3H2O
Fe2O3+6H+=2Fe3++3H2O
,反应后得到黄色的FeCl
3溶液.用此溶液做以下实验:
②取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为
Fe3++3O H-=Fe(OH)3↓
Fe3++3O H-=Fe(OH)3↓
.
③在小烧杯中加入25mL蒸馏水,加热至沸腾后,向沸水中加入2mL FeCl
3饱和溶液,继续煮沸至溶液呈
红褐
红褐
色,即可制得Fe(OH)
3胶体.
④另取一小烧杯加入25mL蒸馏水后,向烧杯中再加入2mL FeCl
3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)
3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到
乙
乙
(填甲或乙)烧杯中会产生丁达尔效应.此实验可以区别
溶液和胶体
溶液和胶体
.

