
题目列表(包括答案和解析)
先在表中空白处填写相关的内容,再根据表中提供的信息回答下面的问题.

由蒸发海水制得的粗盐中常含有Na2SO4、CaCl2和MgCl2等杂质,在食盐生产过程中需要将这些杂质除去.请回答:
(1)Na2SO4、CaCl2和MgCl2在溶液里能形成Na+、Ca2+、Mg2+、![]() 和Cl-五种离子.要除去其中的Mg2+,可使用氢氧化钠溶液;除去其中的
和Cl-五种离子.要除去其中的Mg2+,可使用氢氧化钠溶液;除去其中的![]() ,可使用________溶液;除去其中的Ca2+,可使用________溶液.
,可使用________溶液;除去其中的Ca2+,可使用________溶液.
(2)在食盐生产的除杂过程中,会带进![]() 和OH-.要同时除去这两种杂质离子,最简便的方法是加入适量的________,并用________测定溶液的酸碱性.
和OH-.要同时除去这两种杂质离子,最简便的方法是加入适量的________,并用________测定溶液的酸碱性.
先在表中空白处填写相关的内容,再根据表中提供的信息回答下面的问题.
由蒸发海水制得的粗盐中常含有Na2SO4、CaCl2和MgCl2等杂质,在食盐生产过程中需要将这些杂质除去.请回答:
(1)Na2SO4、CaCl2和MgCl2在溶液里能形成Na+、Ca2+、Mg2+、![]() 和Cl-五种离子.要除去其中的Mg2+,可使用氢氧化钠溶液;除去其中的
和Cl-五种离子.要除去其中的Mg2+,可使用氢氧化钠溶液;除去其中的![]() ,可使用________溶液;除去其中的Ca2+,可使用________溶液.
,可使用________溶液;除去其中的Ca2+,可使用________溶液.
(2)在食盐生产的除杂过程中,会带进![]() 和OH-.要同时除去这两种杂质离子,最简便的方法是加入适量的________,并用________测定溶液的酸碱性.
和OH-.要同时除去这两种杂质离子,最简便的方法是加入适量的________,并用________测定溶液的酸碱性.
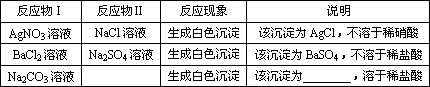
反应物Ⅰ | 反应物Ⅱ | 反应现象 | 说明 |
AgNO3溶液 | NaCl溶液 | 生成白色沉淀 | 该沉淀为AgCl,不溶于稀硝酸 |
BaCl2溶液 | Na2SO4溶液 | 生成白色沉淀 | 该沉淀为BaSO4,不溶于稀盐酸 |
Na2CO3溶液 | __________ | 生成白色沉淀 | 该沉淀为__________,溶于稀盐酸 |
由蒸发海水制得的粗盐中常含有Na2SO4、CaCl2和MgCl2等杂质,在食盐生产过程中需要将这些杂质除去。请回答:
(1)Na2SO4、CaCl2和MgCl2在溶液里能形成Na+、Ca2+、Mg2+、![]() 和Cl-五种离子。要除去其中的Mg2+,可使用氢氧化钠溶液;除去其中的
和Cl-五种离子。要除去其中的Mg2+,可使用氢氧化钠溶液;除去其中的![]() ,可使用____________________溶液;除去其中的Ca2+,可使用____________________溶液。
,可使用____________________溶液;除去其中的Ca2+,可使用____________________溶液。
(2)在食盐生产的除杂过程中,会带进![]() 和OH-。要同时除去这两种杂质离子,最简便的方法是加入适量的,并用______________________测定溶液的酸碱性。
和OH-。要同时除去这两种杂质离子,最简便的方法是加入适量的,并用______________________测定溶液的酸碱性。
实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
|
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/cm3)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、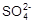 等杂质)用盐酸将滤液的pH值调至7。
等杂质)用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是______________________;
(2)步骤②中,SO42-是否需要除去?_________,理由是________________
(3)步骤④中所有操作的共同目的是_____________;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是____________,在通常情况下,检验这种阳离子的方法_______________________。
(8分)实验室可用NH4HCO3和NaCl为原料制备纯碱。请根据下表数据和实验步骤,回答下列问题: 30℃时几种盐的溶解度/g
|
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
Na2SO4 |
(NH4)2SO4 |
CaCl2 |
MgCl2 |
CaSO4 |
|
36.3 |
27.0 |
11.1 |
41.4 |
40.8 |
78 |
51.7 |
26.2 |
0.165 |
制备纯碱的步骤如下:
① 配制50 mL约25%的粗食盐水溶液(密度近似为1 g/mL)。
② 精制食盐水(粗食盐中含有少量Ca2+、Mg2+、SO42-等杂质),用盐酸将滤液的pH值调至7。
③ 加热食盐水,将溶液温度控制在30 ─ 35℃。
④ 在不断搅拌下,分次将研细的NH4HCO3加入食盐水中,加完料后,继续保温、 搅拌半小时。
⑤ 静置,趁热过滤,回收母液。晶体用蒸馏水洗涤两次。
⑥ 将晶体灼烧,得到纯碱。
(1)步骤①中,配制溶液的最后一步操作是 ;
(2)步骤②中,SO42-是否需要加入某种试剂除去? ,理由是
(3)步骤④中所有操作的共同目的是 ;
(4)步骤⑤中晶体的洗涤液中主要含有的杂质阳离子是 ,在通常情况下,检验这种阳离子的实验操作为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com