
题目列表(包括答案和解析)
烧碱和氯气都是重要的基本化工原料,它们大多来自氯碱工业,氯碱工业的工艺流程如下图所示:
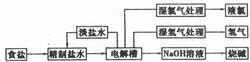
(1)电解饱和食盐水的总反应方程式为______,阳极发生的电极反应为_______。
(2)工业生产用的食盐水进入电解槽之前需精制,请简要说明需要精制的原因。
(3)目前氯碱工业主要采用的方法有三种,它们各有特点(见表)。
| 方法 | 电解槽特点 | 产品中氯 化钠含量 | 电解液中氢 氧化钠含量 | 总能耗 (kW.h?t-1) | 其他 |
| 隔膜法 | 使用石棉纤维制成的隔膜隔开阴阳极 | 较大 | 低 | 高 | 细微石棉吸入人的肺内有损健康,目前正被离子膜交换法取代 |
| 汞法 | 由独立的电解室和解汞室构成,氯气和氢气在不同的室产生 | 低 | 很高 | 高 | 汞易对环境造成污染,在我国已经被淘汰 |
| 离子交换膜法 | 使用能选择性通过离子的离子膜替代隔膜法中石棉隔膜 | 很低 | 较高 | 低 | 占地少、生产能力大、能连续生产,是氯碱工业的发展方向 |
请比较三种方法的优缺点,指出哪些方面的主要因素不断促进着电解槽革新。
(4)氯碱化工厂的选址比较特殊,如通常不会单独建氯碱化工厂,而是与农药厂、有机化工、制药厂、盐酸厂等建在一起,请分析这种建厂方式的原因和所带来的好处
(1)近年来,某些自来水厂在用液氯进行处理的同时还加入少量液氨,其反应的化学方程式为:NH3+HClO![]() H2O+NH2Cl(一氯氨),NH2Cl较稳定。加液氨能延长液氯杀菌时间的原因是_____________________________________________________________________。
H2O+NH2Cl(一氯氨),NH2Cl较稳定。加液氨能延长液氯杀菌时间的原因是_____________________________________________________________________。
(2)科研人员发现在用氯消毒的饮用水中,含有微量对人体有潜在危害作用的含氯化合物。世界环保联盟即将全面禁止在自来水中加氯气,推广采用广谱性高效杀菌消毒剂二氧化氯(ClO2,黄绿色气体)。目前欧洲和我国主要采用Kesting法(原料为氯酸钠和盐酸)制ClO2,该法的缺点是同时产生Cl2(占ClO2体积的一半),使产物纯度低。
①试写出该法制ClO2的化学反应方程式:__________________________________________。
②Cl2和ClO2都是通过氧化作用而杀菌消毒,试计算在等质量时,ClO2的氧化能力是Cl2的_________倍。
(提示:等质量时的氧化能力可理解为当质量相等时两物质得到电子数数目之比。)
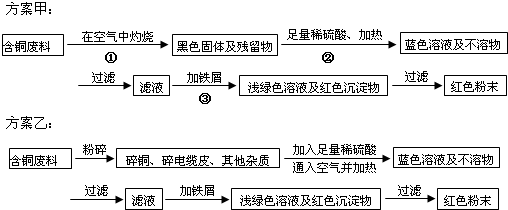
钛被认为是21世纪的重要金属材料.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.
Ⅰ.目前大规模生产钛的方法是:
第一步 首先将金红石(TiO2)、炭粉混合,在高温条件下通入氯气制得TiCl4;
第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛.
已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)
ΔH=-566 kJ·mol-1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则
:TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________.Ⅱ.
纳米TiO2可通过TiCl4水解制备,过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1 mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2.(1) TiCl4水解生成TiO2·x H2O的化学方程式为________.
(2)简述升温和调节溶液pH的目的:________.
Ⅲ.在制造TiO2过程中,需要测定Ti(Ⅳ)的含量.测定时首先将TiO2溶解为钛液,然后取10 mL用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应:
Ti(Ⅳ)+Al→Ti3++Al3+.过滤后,取出滤液20 mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1 mol/L FeCl3溶液,终点到来时,用去了30 mL的FeCl3溶液.
(1)滴定终点的现象是________.
(2)原钛液的物质的量浓度为________.
(3)若在滴定终点读取滴定管刻度时,俯视标准液液面,则使Ti(Ⅳ)的含量测定结果________(填“偏高”、“偏低”或“无影响”).
(10分)钛被认为是21世纪的重要金属材料。纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
Ⅰ.目前大规模生产钛的方法是:第一步 首先将金红石(TiO2)、炭粉混合,在高温条件下通入氯气制得TiCl4;第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛。
已知:① C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ② 2CO(g)+O2(g)=2CO2(g)
△H=-566kJ·mol-1 ③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ·mol-1
则:TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
Ⅱ.纳米TiO2可通过TiCl4水解制备,过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2。⑴TiCl4水解生成TiO2·x H2O的化学方程式为_____________________。
⑵简述升温和调节溶液pH的目的: 。
Ⅲ.在制造TiO2过程中,需要测定Ti(Ⅳ)的含量。测定时首先将TiO2溶解为钛液,然后取10mL用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应:
Ti(Ⅳ)+Al→Ti3++Al3+。过滤后,取出滤液20mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/L FeCl3溶液,终点到来时,用去了30mL的FeCl3溶液。⑴滴定终点的现象是____________________________________。[来
⑵原钛液的物质的量浓度为 。
⑶若在滴定终点读取滴定管刻度时,俯视标准液液面,则使Ti(Ⅳ)的含量测定结果_________(填“偏高”、“偏低”或“无影响”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com