
题目列表(包括答案和解析)
甲、乙、丙三位同学分别进行“Na2CO3和NaCl混合物中Na2CO3质量分数测定”的实验:
(1)甲同学实验的主要步骤有:①过滤 ②加入足量的CaCl2溶液 ③将沉淀小心烘干、称量,测得固体质量为ng ④称取mg样品溶于适量蒸馏水 ⑤洗涤沉淀2-3次.该同学正确的操作步骤为________(填序号);混合物中碳酸钠的质量分数为________(只需列出计算式).
(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,实验室中只有如下试剂:样品、6 mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液.回答下列问题:
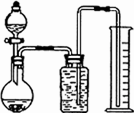
①广口瓶中盛放的溶液是________.
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是________________________
(3)丙同学准确称取w g固体混合物放入锥形瓶中,加入V1 mL 0.1000 mol/L盐酸,充分反应,用0.1000 mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL.请回答下列问题:
①实验室现有1.000 mol/L盐酸溶液.为了精确配制10 mL 0.1000 mol/L的盐酸溶液,需要的仪器有:烧杯、100 mL容量瓶、玻璃棒、________.
②滴定时选择________作指示剂,滴定终点溶液的颜色变化为________.
③混合物中碳酸钠的质量分数为________(只需列出计算式).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com