
题目列表(包括答案和解析)
|
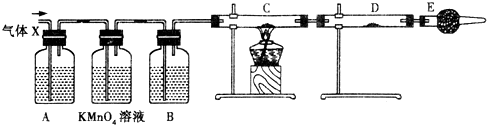
某课外活动小组,为了研究金属的腐蚀和防护原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图所示装置进行实验,过一段时间后观察,下列现象不可能出现的是
| |
| [ ] | |
A. |
烧杯中导气管内产生气泡 |
B. |
烧杯中导气管里形成一段水柱 |
C. |
金属片剪口变红 |
D. |
锌被腐蚀 |
| ||
| ||
 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| Q2-Q1 |
| 2 |
| Q2-Q1 |
| 2 |
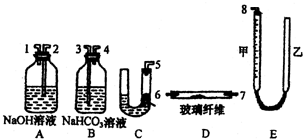 (实验化学)某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积.如图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水.甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低.
(实验化学)某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积.如图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水.甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com