
题目列表(包括答案和解析)
温度/℃ | NaNO3 | KNO3 | NaCl | KCl |
10 | 80.5 | 20.9 | 35.7 | 31.0 |
100 | 175 | 246 | 39.1 | 56.6 |
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)

某同学设计用物质的量比为1∶1的硝酸钠和氯化钾原料,加入一定量的水制取硝酸钾的实验,其流程如上图所示。
(1)在①和③的实验过程中,关键的实验条件是____________________________________。
(2)分离晶体的②和④的操作是_______________(填“倾倒”“蒸发”“结晶”或“过滤”中的某种操作),硝酸钾是晶体_______________(填“A”或“C”)。
(3)粗产品中可能含有的杂质离子是_____________,检验方法是_____________________
____________________________________________________________________。
(4)欲将粗产品提纯,可采取的方法是_____________________________________。


下面是四种盐在不同温度下的溶解度(g/100g H2O),(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)

某同学设计用物质的质量比为85∶74.5的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验.其流程如下:

(1)在①和③的实验过程中,关键的实验条件是________.
(2)分离出晶体的②和④的操作是________(填“倾倒”、“蒸发”、“结晶”或“过滤”),硝酸钾晶体是________(填“A”或“C).
(3)粗产品中可能含有的杂质离子是________,检验方法是__________________________.
(4)欲将粗产品提纯,可采取的方法是________________________________________.
下面是4种盐在不同温度下在水中的溶解度.

(假设:①盐类共存时不影响各自的溶解度.②分离晶体时,溶剂的损耗忽略不计.)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下:

(1)在①和③的实验过程中,关键的实验条件是_________.
(2)分离出晶体②和④的操作是_________(填“倾倒”、“蒸发”、“结晶”、“过滤”中的某种操作).硝酸钾是晶体_________(填A或C).
(3)粗产品中可能含有的杂质离子是_______,检验的方法是_________.
(4)欲将粗产品提纯,可采取的方法是__________.
下表是四种盐在不同温度下的溶解度(g/100g![]() ):
):
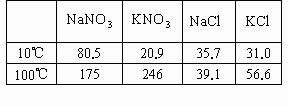
(假设:①盐类共存时不影响各自的溶解度;②分离晶体时,溶剂的损耗忽略不计)某同学设计用物质的量比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图:

(1)在①和③的实验过程中,实验的关键条件是________;
(2)分离出晶体的②和④的操作是________(填“倾倒”、“蒸发”、“结晶”或“过渡”),硝酸钾是晶体________(填“A”或“C”);
(3)粗产品中可能含有的杂质离子是________,检验的方法是___________________________;
(4)欲将粗产品提纯,可采用的方法是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com